В неустойчивой коллоидной системе превалируют силы притяжения. Устойчивость и коагуляция дисперсных систем
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Книга:
| <<< Назад
|
Вперед >>>
|
Как указывалось в § 106, качественная особенность дисперсных систем состоит в их агрегативной неустойчивости.
Предотвращение агрегации первичных дисперсных частиц возможно в результате действия трех факторов устойчивости дисперсных систем: 1) кинетического, 2) электрического и 3) структурно-механического.
Необходимым условием слипания двух частиц дисперсной фазы является их сближение, достаточное для проявления сил притяжения. Если частота столкновений коллоидных частиц мала, то дисперсная система может быть устойчивой (кинетический фактор устойчивости). Это может иметь место при очень малой концентрации дисперсных частиц (например, в некоторых аэрозолях) или при очень большой вязкости дисперсионной среды (например, в дисперсных системах типа T 1 -T 2).
Рис. 102. Схема перекрывания ионных атмосфер двух коллоидных частиц.
Большинство устойчивых дисперсных систем кроме дисперсной фазы и дисперсионной среды содержат еще 3-й компонент, являющийся стабилизатором дисперсности. Стабилизатором могут быть как ионы, так и молекулы, в связи с чем различают два механизма стабилизации дисперсных систем: электрический и молекулярно-адсорбционный (стр. 324),
Электрическая стабилизация дисперсных систем связана с возникновением двойного электрического слоя на границе раздела фаз. Такая стабилизация имеет основное значение для получения устойчивых лиозолей и суспензий в полярной среде, например в воде. В любом гидролизе все коллоидные частицы имеют одинаковый знак заряда. Однако коллоидная мицелла в целом электронейтральна в результате образования двойного электрического слоя. Поэтому электростатическое отталкивание между коллоидными частицами (электрический фактор устойчивости) возникает только при достаточном их сближении, когда происходит перекрывание их ионных атмосфер (рис. 102). Потенциальная энергия электростатического отталкивания тем больше, чем больше перекрывание диффузных частей двойного электрического слоя коллоидных частиц, т. е. чем меньше расстояние (x) между ними и чем больше толщина двойного электрического слоя.
Кроме электростатического отталкивания между коллоидными частицами, как и между молекулами любого вещества, действуют межмолекулярные силы притяжения, среди которых наибольшую роль играют дисперсионные силы. Действующие между отдельными молекулами дисперсионные силы быстро убывают с увеличением расстояния между ними. Но взаимодействие коллоидных частиц обусловлено суммированием дисперсионных сил притяжения между всеми молекулами, находящимися на поверхности контакта коллоидных частиц. Поэтому силы притяжения между коллоидными частицами убывают медленнее и проявляются на больших расстояниях, чем в случае отдельных молекул.
Потенциальная энергия взаимодействия (U) между коллоидными частицами представляет собой алгебраическую сумму потенциальной энергии электростатического отталкивания (U э) и потенциальной энергии дисперсионного притяжения (U д) между ними:
Если U э > U д (по абсолютной величине), то отталкивание преобладает над притяжением и дисперсная система устойчива.

Рис. 103. Потенциальная энергия взаимодействия между двумя одинаково заряженными частицами: 1 - электрическое отталкивание (U э) 2 - дисперсионное притяжение (U д); 3 - результирующая энергия взаимодействия (U); 4 - то же, но при более крутом падении кривой 1; х - расстояние между частицами; U макс - потенциальный барьер взаимодействия дисперсных частиц.
Если Если U э < U д, то происходит слипание сталкивающихся при броуновском движении коллоидных частиц в более крупные агрегаты и седиментация последних. Коллоидный раствор коагулирует, т. е. разделяется на коагулят (осадок) и дисперсионную среду.
В этом состоит сущность теории электрической стабилизации и коагуляции дисперсных систем, развитой впервые Б. В. Дерягиным (1937), а затем Л. Д. Ландау и голландскими учеными Фервеем и Овербеком (1948 г.); по первым буквам фамилий авторов ее называют теорией ДЛФО.
На рис. 103 приведены зависимости величин U д и U э от расстояния между коллоидными частицами. При этом, как принято в физике, потенциальной энергии притяжения приписывается знак минус, а отталкивания - знак плюс. Как видно, результирующая энергия взаимодействия (кривая 3 на рис. 103) приводит к притяжению (U<0) на очень малых и отталкиванию (U>0) на больших расстояниях между частицами. Решающее значение для устойчивости дисперсных систем имеет величина потенциального барьера отталкивания U макс, которая, в свою очередь, зависит от хода кривых U д и U э. При больших значениях этого барьера коллоидная система устойчива. Слипание коллоидных частиц возможно лишь при достаточном их сближении. Это требует преодоления потенциального барьера отталкивания. При некоторых небольших положительных значениях U макс (кривая 3) преодолеть его могут лишь немногие коллоидные частицы с достаточно большой кинетической энергией. Это соответствует стадии медленной коагуляции, когда только небольшая часть соударений коллоидных частиц приводит к их слипанию. При медленной коагуляции со временем происходит некоторое уменьшение общего числа коллоидных частиц в результате образования агрегатов из первичных частиц, но коагулят не выпадает. Подобную коагуляций, не сопровождающуюся видимым изменением коллоидного раствора, называют скрытой коагуляцией.
При дальнейшем уменьшении потенциального барьера скорость коагуляции, характеризуемая изменением числа частиц в единицу времени, возрастает. Наконец, если потенциальный барьер переходит из области отталкивания в область притяжения (кривая 4 на рис. 103), наступает быстрая коагуляция, когда каждое соударение коллоидных частиц приводит к их слипанию; в коллоидном растворе образуется осадок - коагулят, происходит явная коагуляция.
Потенциальный барьер отталкивания (U макс) возникает в результате суммирования сил отталкивания и притяжения, действующих между коллоидными частицами. Поэтому все факторы, влияющие на ход кривых 1 и 2 (рис. 103), приводят к изменению как величины U макс, так и положения максимума (т. е. расстояния X, соответствующего U макс).
Значительное уменьшение U макс происходит в результате изменения потенциальной энергии электростатического отталкивания (т. е. хода кривой 1), вызванного добавлением электролитов к коллоидному раствору. С увеличением концентрации любого электролита происходит перестройка двойного электрического слоя, окружающего коллоидные частицы: все большая часть противо-ионов вытесняется из диффузной в адсорбционную часть двойного Электрического слоя. Толщина диффузной части двойного электрического слоя (слой 4 на рис. 100), а вместе с ней и всего двойного электрического слоя (слой 2 на рис. 100) уменьшается. Поэтому кривая потенциальной энергии электростатического отталкивания снижается более круто, чем показанная на рис. 103 кривая 1. В результате этого потенциальный барьер отталкивания (U макс) уменьшается и смещается в сторону меньшего расстояния между коллоидными частицами. Когда двойной электрический слой сжимается до толщины адсорбционного слоя (слой 8 на рис. 100), то вся кривая взаимодействия дисперсных частиц оказывается в области притяжения (кривая 4 на рис. 103), наступает быстрая коагуляция. Такое изменение устойчивости коллоидного раствора происходит при добавлении любого электролита.
Коагулирующее действие электролитов характеризуют порогом коагуляции, т. е. наименьшей концентрацией электролита, вызывающей коагуляцию. В зависимости от природы электролита и коллоидного раствора порог коагуляции изменяется в пределах от 10 -5 до 0,1 моль в литре золя. Наиболее существенное влияние на порог коагуляции оказывает заряд коагулирующего иона электролита, т. е. иона, заряд которого противоположен по знаку заряду коллоидной частицы.
Многозарядные противоионы электролита имеют повышенную адсорбционную способность по сравнению с однозарядными и проникают в адсорбционную часть двойного электрического слоя в больших количествах. При этом порог коагуляции уменьшается не пропорционально заряду противоиона, а значительно быстрее.
Блестящим подтверждением теории ДЛФО явился расчет Б. В. Дерягиным и Л. Д. Ландау (1941 г.) соотношения значений порогов коагуляции вызываемой электролитами, содержащими ионы с разной величиной заряда. Оказалось, что порог коагуляции обратно пропорционален шестой степени заряда коагулирующего иона. Следовательно, значения порогов коагуляции для одно-, двух-, трех- и четырехзарядных ионов должны относиться, как
что близко к соотношениям концентраций электролитов, которые наблюдались при коагуляции разнообразных гидрозолей. Сказанное иллюстрируют данные табл. 22, где приведены эквивалентные концентрации электролитов C к, вызывающие коагуляцию гидрозоля оксида мышьяка(III).
Таблица 22. Пороги коагуляции (C к) отрицательно заряженного золя As 2 O 3 электролитами

Молекулярно-адсорбционная стабилизация дисперсных систем играет большую роль в устойчивости дисперсий как в водной, так и в неводных средах. Дисперсные системы в неводных средах в принципе менее устойчивы, чем в водной среде. В неполярной и не содержащей воды дисперсионной среде частицы дисперсной фазы лишены электрического заряда. Электрический фактор стабилизации отсутствует. Между дисперсными частицами действуют только силы взаимного притяжения. Ослабление этих сил, приводящее к стабилизации дисперсных систем, может происходить в результате образования вокруг коллоидных частиц адсорбционных слоев из молекул дисперсионной среды и растворенных в ней веществ. Такие слои ослабляют взаимное притяжение частиц дисперсной фазы и создают механическое препятствие их сближению.
Стабилизация дисперсных систем за счет сольватации дисперсной фазы молекулами дисперсионной среды возможна как в полярных, так и в неполярных средах. Так, гидратация частиц глины и кремниевой кислоты имеет существенное значение для устойчивости суспензий глин и золя кремниевой кислоты в водной среде.
Однако стабилизация дисперсных систем значительно более эффективна при добавлений к ним поверхностно-активных веществ (ПАВ) и высокомолекулярных соединений, адсорбирующихся на границе раздела фаз. Адсорбционные слои ПАВ и высокомолекулярных соединений, обладая упругостью и механической прочностью, предотвращают слипание дисперсных частиц. Образование таких молекулярно-адсорбционных твердообразных поверхностных слоев П. А. Ребиндер назвал структурно-механическим фактором стабилизации дисперсных систем. Этот механизм стабилизации играет основную роль при получении предельно устойчивых высококонцентрированных пен, эмульсий, коллоидных растворов и суспензий не только в неводных, но и в водных средах. Для структурно-механической стабилизации дисперсий в водной среде применяют мыла щелочных металлов, белки, крахмал, а в неводных средах - мыла щелочноземельных металлов, смолы, каучуки. Такие вещества называют защитными коллоидами.
| <<< Назад
|
Вперед >>>
|
Под устойчивостью дисперсных систем понимают неизменность их свойств и состава во времени, в том числе дисперсности фазы, межчастичного взаимодействия. Здесь рассматриваются вопросы устойчивости систем по отношению к укрупнению или агрегации частиц дисперсной фазы, к их осаждению. Ликвидация агрегативной устойчивости необходима в процессах выделения осадков при разделении фаз, при очистке сточных вод и промышленных выбросов.
По классификации П.А. Ребиндера дисперсные системы делят на лиофильные, получающиеся при самопроизвольном диспергировании одной из фаз, и лиофобные, получающиеся при принудительном диспергировании и конденсации с пересыщением. Лиофобные системы обладают избытком поверхностной энергии, в них самопроизвольно могут идти процессы укрупнения частиц, т.е. может происходить снижение поверхностной энергии за счет уменьшения удельной поверхности. Такие системы и называют агрегативно неустойчивыми.
Агрегация частиц может заключаться в переносе вещества от мелких частиц к крупным, так как химический потенциал последних меньше /изотермическая перегонка/. Крупные частицы растут, а мелкие частицы постепенно растворяются /испаряются/. Агрегация частиц может происходить и путем слипания /слияния/ частиц – наиболее характерный путь для дисперсных систем /коагуляция/.
Различают термодинамические и кинетические факторы агрегативной устойчивости дисперсных систем. Движущей силой коагуляции является избыточная поверхностная энергия. Основными факторами, влияющими на устойчивость систем, являются факторы, снижающие поверхностное натяжение при сохранении размера поверхности. Эти факторы относят к термодинамическим. Они уменьшают вероятность эффективных соударений частиц, создают потенциальные барьеры, замедляющие или даже исключающие процесс коагуляции. Чем меньше поверхностное натяжение, тем больше термодинамическая устойчивость системы.
Кинетические факторы связаны в основном с гидродинамическими свойствами среды: замедление сближения частиц, разрушение прослоек среды между частицами. В целом, различают следующие факторы устойчивости дисперсных систем:
1. Гидродинамический – из-за изменения вязкости среды и плотности фазы и дисперсионной среды снижается скорость коагуляции;
2. Структурно – механический фактор обусловлен наличием на поверхности частиц упругой, механически прочной пленки, разрушение которой требует затрат энергии и времени;
3. Электростатический – из-за возникновения двойного электростатического слоя/ДЭС/ на поверхности частиц уменьшается межфазное натяжение. Появление электрического потенциала на межфазной поверхности возможно из-за поверхностной электролитической диссоциации или адсорбции электролитов;
4. Энтропийный фактор проявляется в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении. Сущность его состоит в стремлении дисперсной фазы к равномерному распределению по объему системы;
5. Адсорбционно-сольватный – проявляется в уменьшении межфазного натяжения вследствие адсорбции и сольватации при взаимодействии частиц с дисперсионной средой.
В реальных системах агрегативная устойчивость определяется одновременно совокупностью термодинамических и кинетических факторов.
Согласно современным представлениям устойчивость систем (лиофобных коллоидов) определяется балансом сил молекулярного притяжения и электростатического отталкивания между частицами. Универсальным свойством дисперсных систем является наличие на границе раздела фаз двойного электрического слоя (ДЭС).
Поверхностный заряд частиц образуется в результате одного из процессов:
– диссоциации поверхностных групп частиц;
– адсорбции потенциалопределяющих ионов, т.е. ионов, входя щих в состав кристаллической решетки или сходных с ними;
– адсорбции ионогенных ПАВ;
– изоморфного замещения, например, заряд частиц большинства глин формируется за счет замещения четырехвалентных ионов кремния на Аl +3 или Са +2 , с дефицитом положительного заряда на частице.
В первых трех случаях поверхностный заряд можно контролировать, в определенных пределах регулировать величину заряда, знак, изменяя концентрацию ионов в системе. Например, в результате диссоциации поверхностных силанольных групп частицы кремнезема могут приобретать заряд:
Плотность поверхностного заряда равна числу элементарных зарядов на единице поверхности. Поверхностный заряд частицы в дисперсной системе компенсируется суммой зарядов, локализованных в диффузной и плотной (непосредственно прилегающей части монослоя противоионов) частях ДЭС.
Явление возникновения разности потенциалов при осаждении дисперсной фазы получило название потенциала седиментации /оседания/. При относительном перемещении фаз независимо от причин, вызывающих перемещение, происходит разрыв ДЭС по плотности скольжения. Плоскость скольжения обычно проходит по диффузному слою ДЭС, и часть его ионов остается в дисперсионной среде. В результате дисперсионная среда и ее дисперсная фаза оказываются противоположно заряженными. Потенциал, возникающий на плоскости скольжения при отрыве части диффузного слоя, называется электрокинетическим потенциалом, или z /дзета/-потенциалом. Дзета-потенциал, отражая свойства ДЭС, характеризует природу фаз и межфазного взаимодействия. Величина электрокинетического потенциала зависит от скорости движения фаз, вязкости среды, природы фаз и других факторов. Понижение температуры, введение в систему электролитов, специфически взаимодействующих с поверхностью, увеличение заряда ионов электролита приводит к уменьшению дзета-потенциала.
Величина дзета-потенциала зависит от природы поверхности контактирующих фаз. На поверхностях полиэлектролитов, содержащих ионогенные группы, а так же на поверхности многих неорганических оксидов величина дзета-потенциала может достигать высоких значений - 100 мВ и более. Если на поверхности адсорбируются противоионы, то электрокинетический потенциал уменьшается. Значительное влияние оказывает величина рН среды, так как ионы Н + и ОН – обладают высокой адсорбционной способностью. Знак и значение дзета-потенциала широко используются для характеристики электрических свойств поверхностей при рассмотрении агрегативной устойчивости дисперсных систем.
В первом приближении принято считать, что устойчивость дисперсных систем определяется величиной электрокинетического z (дзета) потенциала. При добавлении к системам электролитов или ПАВ происходит изменение структуры ДЭС, изменение величины z – потенциала при неизменной величине поверхностного потенциала. Это изменение (уменьшение) наиболее значительно с ростом заряда противоиона при одинаковой концентрации электролита (рис.2.1).
Высокозарядные противоионы /Al +3 ,Fe +3 /, сложные органические ионы вследствие действия вандерваальсовых сил могут адсорбироваться сверхэквивалентно, т.е. в количествах, превышающих число зарядов на поверхности, накапливаясь в слое. В результате этого возможно изменение и величины, и знака электрокинетического потенциала. С такими явлениями часто встречаются при введении в дисперсные системы полиэлектролитов и коагулянтов.
В дисперсных системах при сближении одинаково заряженных частиц происходит их отталкивание, что не является чисто кулоновским, так как заряд поверхности полностью компенсирован зарядом противоионов. Силы отталкивания появляются при перекрывании диффузных ионных атмосфер. В тоже время между частицами действует вандерваальсово притяжение, состоящее из ориентационных, индукционных и дисперсионных сил. В определенных условиях эти силы соизмеримы с силами отталкивания. Полная энергия взаимодействия дисперсных частиц слагается из суммы энергий притяжения и отталкивания. Величина суммарной энергии частиц от расстояния между ними схематически показана на рис.2.2.
Рис.2.1. Зависимость величины z - потенциала от концентрации противоионов. На кривых указан заряд противоиона
Устойчивость дисперсных систем и коагуляция отражают непосредственно взаимодействие частиц дисперсной фазы между собой или с какими-либо макроповерхностями. В основе теории устойчивости лежит соотношение между силами притяжения и отталкивания частиц. Широкое признание получила теория устойчивости, впервые предложенная Б.В. Дерягиным и Л.Д. Ландау, учитывающая электростатическую составляющую расклинивающего давления (отталкивания) и его молекулярную составляющую (притяжение).
В упрощенном варианте общая энергия взаимодействия между двумя частицами, приходящаяся на единицу площади, равна
Е=Е пр +Е от. (2.1)
Рис.2.2. Зависимость энергии взаимодействия частиц (Е общ) от расстояния между ними (L ), Е общ =Е притяж +Е отталк
Каждую из этих составляющих можно выразить как функцию от расстояния между частицами
dЕ пр =Р пр dh, (2.2)
dE от =Р от dh, (2.3)
где Р пр – давление притяжения, т.е. молекулярная составляющая расклинивающего давления; Р от – давление отталкивания, в данном случае электростатическая составляющая расклинивающего давления.
Давление притяжения обусловлено обычно стремлением системы к уменьшению поверхностной энергии, его природа связана с ван-дер-ваальсовыми силами. Давление отталкивания обусловлено только электростатическими силами, поэтому
dР от = d , (2.4)
где - объемная плотность заряда в ЭДС, - электропотенциал двойного слоя.
Если частицы находятся на расстояниях, на которых взаимодействие не происходит, то ДЭС не перекрываются, и потенциалы в них практически равны нулю. При сближении частиц ДЭС перекрываются, в результате потенциалы значительно увеличиваются вплоть до 2 и силы отталкивания возрастают.
В области малых значений потенциалов электростатическая составляющая давления сильно зависит от значения потенциала, с ростом же потенциала эта зависимость становится менее заметной. Энергия отталкивания частиц возрастает с уменьшением расстояния h между ними по экспоненциальному закону.
Энергия притяжения частиц согласно упрощенному уравнению 2.5.обратно пропорциональна квадрату расстояния между ними.
Р пр = - , (2.5)
где n – число атомов в единице объема частицы; К – константа, зависящая от природы взаимодействующих фаз;
Энергия притяжения между частицами значительно медленнее уменьшается с расстоянием, чем энергия притяжения между молекулами (атомами). Отсюда следует, что частицы дисперсных систем взаимодействуют на более далеких расстояниях, чем молекулы.
Устойчивость дисперсных систем или скорость коагуляции зависит от знака и значения общей потенциальной энергии взаимодействия частиц. Положительная энергия отталкивания Е от с увеличением h уменьшается по экспоненциальному закону, а отрицательная Е пр обратно пропорциональна квадрату h. В результате на малых расстояниях (при h®0, Е от ®const, E пр ® ) и на больших расстояниях между частицами преобладает энергия притяжения, а на средних – энергия электростатического отталкивания.
Первичный минимум I (рис 2.2) отвечает непосредственному слипанию частиц, а вторичный минимум II – их притяжению через прослойку среды. Максимум, соответствующий средним расстояниям, характеризует потенциальный барьер, препятствующий слипанию частиц. Силы взаимодействия могут распространяться на расстояния до сотен нм, а максимальное значение энергии может превышать 10 -2 Дж/м 2 . Увеличению потенциального барьера способствует рост потенциала на поверхности частиц в области его малых значений. Уже при 20 мВ возникает потенциальный барьер, обеспечивающий агрегативную устойчивость дисперсных систем.
В различных отраслях промышленности встречаются дисперсные системы, содержащие разнородные частицы, отличающиеся химической природой, знаком и величиной поверхностного заряда, размерами. Агрегацию таких частиц (коагуляцию) называют гетерокоагуляцией. Это наиболее общий случай взаимодействия частиц при крашении, флотации, образовании донных отложений, осадков сточных вод. Термином взаимная коагуляция обозначают более частный случай – агрегацию разноименно заряженных частиц.
Процесс взаимной коагуляции широко используют на практике для разрушения агрегативной устойчивости дисперсных систем, например, при очистке сточных вод. Так, обработка сточных вод при определенных условиях солями алюминия или железа вызывает быструю коагуляцию взвешенных отрицательно заряженных веществ, взаимодействующих с положительно заряженными частицами гидроксидов алюминия и железа, образующимися при гидролизе солей.
Лиофильные коллоиды характеризуются интенсивным взаимодействием дисперсных частиц со средой и термодинамической устойчивостью системы. Решающая роль в стабилизации лиофильных коллоидов принадлежит сольватным слоям, формирующимся на поверхности дисперсной фазы в результате полимолекулярной адсорбции молекул растворителя. Способность сольватной оболочки препятствовать слипанию частиц объясняют наличием у нее сопротивления сдвигу, мешающему выдавливанию молекул среды из зазора между частицами, а также отсутствием заметного поверхностного натяжения на границе сольватного слоя и свободной фазы. Стабилизации дисперсных систем способствует введение в систему ПАВ. Неионные ПАВ, адсорбируясь на гидрофобных дисперсных частицах, превращают их в гидрофильные и увеличивают устойчивость золей.
Основным методом очистки природных и сточных вод от мелкодисперсных, эмульгированных, коллоидных и окрашенных примесей (1 и 2 группы) является коагуляция и флокуляция. Методы основаны на агрегировании частиц дисперсной фазы с последующим их удалением из воды механическим отстаиванием.
Эффективность и экономичность процессов коагуляционной очистки сточных вод определяется устойчивостью дисперсной системы, которая зависит от ряда факторов: степени дисперсности, характера поверхности частиц, плотности частиц, величины электрокинетического потенциала, концентрации, наличия в сточной воде других примесей, например, электролитов, высокомолекулярных соединений.
Существуют различные способы проведения коагуляции, целесообразность применения которых зависит от факторов обусловливающих агрегативную устойчивость систем.
Агрегативная устойчивость коллоидных систем зависит от их строения.
Обладая большой удельной поверхностью, коллоидные частицы способны адсорбировать из воды ионы, вследствие чего соприкасающиеся фазы приобретают заряды противоположного знака, но равные по величине. В результате на поверхности возникает двойной электрический слой. Ионы относительно прочно связанные с дисперсной твердой фазой называют потенциалопределяющими . Они нейтрализуются избытком противоионов . Толщина двойного слоя в водных растворах не превышает 0,002 мм.
Степень адсорбции ионов зависит от сродства адсорбируемых ионов к поверхности, их способности образовывать недиссоциируемые поверхностные соединения. При адсорбции ионов одинаковой валентности адсорбционная способность повышается с увеличением радиуса иона и, соответственно, его поляризуемости, т.е. способности притягиваться к поверхности коллоидной частицы. Увеличение радиуса иона сопровождается также уменьшением его гидратации, наличие плотной гидратной оболочки препятствует адсорбции, т.к. уменьшает электрическое взаимодействие иона с поверхностью коллоидной частицы.
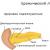
Согласно современным представлениям о строении двойного электрического слоя слой противоинов состоит из двух частей. Одна часть примыкает к межфазной поверхности и образует адсорбционный слой, толщина которого равна радиусу составляющих его гидратированных ионов. Другая часть противоионов находится в диффузном слое, толщина которого зависит от свойств и состава системы. В целом мицелла электронейтральна. Строение мицеллы – коллоидной частицы – представлено на рис.1.1.
Разность потенциалов между потенциалопределяющими ионами и всеми противоионами называется термодинамическим φ-потенциалом.
Заряд на частицах препятствует их сближению, чем, в частности, и определяется устойчивость коллоидной системы. В целом устойчивость коллоидных систем обусловлена наличием заряда у гранулы, диффузионного слоя и гидратной оболочки.
Рис.3.1. Строение мицеллы: Рис.3.2. Схема двойного электрического
I – ядро мицеллы; слоя в электрическом поле
II – адсорбционный слой; (I-II – гранула);
III – диффузионный слой;
IV – гидратная оболочка
При движении частицы в дисперсной системе или при наложении электрического поля часть противоионов диффузного слоя остается в дисперсной среде и гранула приобретает заряд, соответствующий заряду потенциалопределяющих ионов. Таким образом, дисперсионная среда и дисперсная фаза оказываются противоположно заряженными.
Разность потенциалов между адсорбционным и диффузным слоями противоионов называется электрокинетическимζ – потенциалом (рис. 1.2).
Электрокинетический потенциал является одним из важнейших параметров двойного электрического слоя. Величина ζ – потенциала обычно составляет единицы и десятки милливольт в зависимости от состава фаз и концентрации электролита. Чем больше величина ζ– потенциала, тем более устойчива частица.
Рассмотрим термодинамические и кинетические факторы устойчивости дисперсных систем:
· Электростатический фактор устойчивости . С позиции физической кинетики молекулярное притяжение частиц является основной причиной коагуляции системы (ее агрегативной неустойчивости). Если на коллоидных частицах образовался адсорбционный слой, имеющий ионную природу, то при достаточном сближении одноименно заряженных частиц возникают электростатические силы отталкивания. Чем толще двойной электрический слой, тем интенсивнее результирующая сила отталкивание частиц, тем больше высота энергетического барьера и тем меньше вероятность слипания частиц. Таким образом, устойчивость коллоидных систем в присутствии ионного стабилизатора зависит от свойств двойного электрического слоя.
· Сольватационный фактор устойчивости . Силы отталкивания могут быть вызваны существованием на поверхности сближающихся частиц сольватных (гидратных) оболочек или так называемых граничных фаз, состоящих лишь из молекул дисперсионной среды и обладающих особыми физическими свойствами. Ядро мицеллы нерастворимо в воде, следовательно, и не гидратировано. Ионы, адсорбированные на поверхности ядра, и противоионы двойного электрического слоя гидратированы. Благодаря этому вокруг ядра создается ионно-гидратная оболочка. Толщина ее зависит от распределения двойного электрического слоя: чем больше ионов находится в диффузном слое, тем больше и толщина гидратной оболочки.
· Энтропийный фактор устойчивости. Обусловлен тепловым движением сегментов молекул ПАВ, адсорбированных на коллоидных частицах. При сближении частиц, имеющих адсорбционные слои из молекул ПАВ или высокомолекулярных веществ, происходит сильное уменьшение энтропии адсорбционного слоя, что препятствует агрегированию частиц.
· Структурно-механический фактор устойчивости. Адсорбционно-сольватные слои ПАВ могут представлять собой структурно-механический барьер, препятствующий сближению частиц. Защитные слои противоионов-стабилизаторов, являясь гелеобразными, обладают повышенной структурной вязкостью и механической прочностью.
· Гидродинамический фактор устойчивости . Скорость коагуляции может снижаться благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
· Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно. Особенно высокая устойчивость наблюдается при совокупности действия термодинамических и кинетических факторов, когда наряду со снижением межфазного натяжения проявляются структурно-механические свойства межчастичных прослоек.
Необходимо иметь в виду, что каждому фактору устойчивости соответствует специфический метод его нейтрализации. Например, действие электростатического фактора значительно снижается при введении в систему электролитов, которые сжимают двойной электрический слой.
Сольватация при сольватационном факторе может быть исключена лиофобизацией частиц дисперсной фазы с помощью адсорбции соответствующих веществ. Действие структурно-механического фактора можно снизить с помощью веществ, разжижающих и растворяющих упругие структурированные слои на поверхности частиц.
Дестабилизация системы может быть вызвана различными причинами, результатом многих из них является сжатие диффузного слоя, а следовательно, и уменьшение значения ζ-потенциала. Сжатие диффузного слоя уменьшает и степень гидратации ионов, в изоэлектрическом состоянии (ζ= 0, мВ) гидратная оболочка вокруг ядра предельно тонка (10 -10 м) и не защищает мицеллы от слипания при столкновении, в результате начинается агрегация частиц.
Седиментационная устойчивость коллоидных систем (СУ) – способность дисперсной системы сохранять равномерное распределение частиц по всему объему) обусловлена броуновским движением коллоидных дисперсий и диффузией частиц дисперсной фазы.
Седиментационная устойчивость системы зависит от действия двух факторов, направленных взаимно противоположно: силы тяжести, под действием которой частицы оседают, и диффузии, при которой частицы стремятся к равномерному распределению по объему. В результате возникает равновесное диффузионно-седиментационное распределение частиц по высоте, зависящее от их размера.
Диффузия замедляется с увеличением размера частиц. При достаточно высокой степени дисперсности частиц броуновское движение, как движение диффузионное, приводит к выравниванию концентраций по всему объему. Чем меньше частицы, тем больший срок требуется для установления равновесия.
Скорость оседания частиц пропорциональна квадрату их диаметра. В грубодисперсных системах скорость достижения равновесия сравнительно большая и равновесие устанавливается в течение нескольких минут или часов. В тонкодисперсных растворах она мала, и до момента равновесия проходят годы или даже десятки лет.
Виды коагуляции
В современной теории коагуляции дисперсных систем разработанной Дерягиным, Ландау, Фервеем, Овербеком (теория ДЛФО) степень устойчивости системы определяется из баланса молекулярных и электростатических сил. Различают два типа коагуляции:
1) концентрационную, при которой потеря устойчивости частиц связана со сжатием двойного слоя;
2) нейтрализационную (коагуляция электролитами), когда наряду со сжатием двойного слоя уменьшается потенциал φ 1 .
Концентрационная коагуляция характерна для сильно заряженных частиц в высококонцентрированных растворах электролитов. Чем выше потенциала φ 1 ДЭС, тем сильнее противоионы притягиваются к поверхности частиц и своим присутствием экранируют рост электрического поля. Поэтому при высоких значениях φ 1 силы электростатического отталкивания между частицами не возрастают безгранично, а стремятся к некоторому конечному пределу. Этот предел достигается при φ 1 более 250 мв. Отсюда следует, что взаимодействие частиц с высоким φ 1 -потенциалом не зависит от величины этого потенциала, а определяется только концентрацией и зарядом противоионов.
По мере увеличения концентрации электролита величина ζ – потенциала (ДП) снижается, а φ 1 практически сохраняет свое значение (рис. 3.3).
Современная физическая теория коагуляции электролитами основана на общих принципах статистической физики, теории молекулярных сил и теории растворов. Ее авторами являются: Б.В. Дерягин, Л.Д. Ландау (1937-1941), Э. Фервей, Я. Овербек (по первым буквам ДЛФО).
Суть теории: между любыми частицами при их сближении возникает расклинивающее давление разделяющей жидкой прослойки в результате действия сил притяжения и отталкивания. Расклинивающее давление является суммарным параметром, учитывающим действие как сил притяжения, так и сил отталкивания.
Состояние системы зависит от баланса энергии притяжения (U пр) и энергии отталкивания (U отт). Преобладает U отт – устойчивая система. Преобладает U пр - нарушение агрегативной устойчивости – коагуляция.
Изменение энергии взаимодействия между двумя частицами при их сближении изображают графически (рис. 5.3).
Суммарную энергию системы из двух частиц (кривая 3) получают сложением U отт и U пр:
U=U отт +U пр =
где: В – множитель, зависящий от значений электрических потенциалов ДЭС, свойств среды, температуры;
е – основание натурального логарифма;
c – величина, обратная толщине диффузного слоя;
h – расстояние между частицами;
А – константа молекулярных сил притяжения.
|
|||||
|
|||||
|
|||||
Рис.5.3. Потенциальные кривые взаимодействия
коллоидных частиц:
1 – изменение энергии отталкивания с расстоянием;
2 – изменение энергии притяжения;
3 – результирующая кривая.
Рассмотрим результирующую кривую 3 на рис.5.3. На ней имеются характерные участки:
В области малых расстояний имеется глубокий первичный минимум (потенциальная яма) – значительно преобладает U пр. Первичный минимум отвечает непосредственному слипанию частиц (I).
В области больших расстояний - вторичный неглубокий минимум (вторая потенциальная яма, отвечает притяжению через прослойку среды). На схеме II.
В области средних расстояний на кривой имеется максимум и, если он расположен над осью абсцисс, то появляется энергетический барьер сил отталкивания (DU б).
Результирующая кривая 3 может иметь различный вид в зависимости от устойчивости дисперсной системы (рис.5.4.).
|
|||
|
|||
Рис. 5.4. Потенциальные кривые для определенных
состояний устойчивости дисперсной системы:
1 - в системе при любом расстоянии между частицами преобладает энергия притяжения над энергией отталкивания. В такой системе наблюдается быстрая коагуляция с образованием агрегатов.
2 - достаточно высокий потенциальный барьер и наличие вторичного минимума. Частицы взаимодействуют, но не имеют непосредственного контакта и разделены прослойками среды.
3 - система с высокой агрегатной устойчивостью (высокий потенциальный барьер и отсутствие вторичного минимума или при его глубине, меньшей тепловой энергии kТ).
В зависимости от высоты энергетического барьера и глубины потенциальных ям возможны различные варианты поведения частиц при сближении (рис.5.5), частицы обладают кинетической энергией – kТ.
Рис.5.5. Схемы взаимодействия коллоидных частиц
| Состояние в: Малая высота барьера и неглубокий вторичный минимум: DU б @DU я £kT частицы вступают в ближнее взаимодействие, т.е. непосредственно соприкасаются – наступает коагуляция | Состояние а: Характеризуется тем, что перекрываются диффузные слои и сохранены прослойки среды между частицами (гели). Энергетический барьер довольно высок вторичный минимум неглубок: DU я ³kT Взаимодействующие частицы не могут разойтись (удерживают силы притяжения) и не могут приблизиться вплотную (препятствуют силы отталкивания). Добавление электролита чаще всего приводит к коагуляции (уменьшается h). | Состояние б: Высокий энергетический барьер DU б ³kT и отсутствие или неглубокий вторичный минимум DU я £kT: Частицы не могут преодолеть барьер и расходятся без взаимодействия. Такая система агрегативно устойчива. |
Дисперсная система агрегативно устойчива при высоком энергетическом барьере сил отталкивания.
Коллоидные системы характеризуются высокой раздробленностью дисперсной фазы (дисперсностью): размер коллоидных частиц обычно составляет см. Высокая дисперсность обуславливает большую поверхность раздела фаз и как следствие - большую поверхностную энергию Гиббса формула" src="http://hi-edu.ru/e-books/xbook707/files/f287, (9.1)
где s - площадь поверхности раздела фаз, формула" src="http://hi-edu.ru/e-books/xbook707/files/f16.gif" border="0" align="absmiddle" alt=") получили название лиофобных дисперсных систем. Такие системы не могут быть получены самопроизвольным диспергированием, для их образования должна быть затрачена внешняя энергия.
Казалось бы, термодинамически неустойчивые системы не имеют права на существование, они должны быстро терять устойчивость и агрегировать. Однако агрегативная устойчивость таких систем может быть обеспечена кинетическими факторами..gif" border="0" align="absmiddle" alt=" (9.2)
где к - константа, объединяющая физические свойства среды; формула" src="http://hi-edu.ru/e-books/xbook707/files/f289.gif" border="0" align="absmiddle" alt=".gif" border="0" align="absmiddle" alt=" (9.3)
Здесь формула" src="http://hi-edu.ru/e-books/xbook707/files/f292.gif" border="0" align="absmiddle" alt=" (9.4)
и графически передается кривой на рис. 9.1а.
Как видно из рис. 9.1а, на больших и очень малых расстояниях преобладает энергия притяжения частиц (U < 0); на средних расстояниях (формула" src="http://hi-edu.ru/e-books/xbook707/files/f294.gif" border="0" align="absmiddle" alt=" , препятствующему агрегации частиц.
Первый минимум (1) на кривой, соответствует непосредственному соприкосновению частиц, а второй (2) - притяжению частиц, между которыми имеются прослойки среды.
Устойчивость лиофобных систем, стабилизированных электролитами, зависит от соотношения величины электростатического барьера и кинетической энергии частиц формула" src="http://hi-edu.ru/e-books/xbook707/files/f296.gif" border="0" align="absmiddle" alt=", то при столкновении частицы не способны подойти друг к другу на расстояние 1 нм и они не слипаются. Такая система устойчива кинетически, оставаясь неустойчивой термодинамически.
Если формула" src="http://hi-edu.ru/e-books/xbook707/files/f298.gif" border="0" align="absmiddle" alt=" и, согласно (9..gif" border="0" align="absmiddle" alt=" при повышении концентрации постороннего электролита в системе. При достаточно высокой концентрации электролита толщина диффузного слоя уменьшается практически до нуля (изоэлектрическое состояние), исчезает потенциальный барьер (кривая 4), частицы слипаются при всяком столкновении друг с другом.

Рис.9.1.
Зависимость энергии взаимодействия двух частиц U от расстояния между ними - х (а); влияние концентрации электролита на величину потенциального барьера выделение">рис. 9.2.
 случаях адсорбция ПАВ приводит к снижению поверхностной энергии Гиббса и тем самым - к повышению термодинамической устойчивости системы (адсорбционно-сольватный фактор устойчивости).
случаях адсорбция ПАВ приводит к снижению поверхностной энергии Гиббса и тем самым - к повышению термодинамической устойчивости системы (адсорбционно-сольватный фактор устойчивости).
Кроме того, адсорбированные молекулы ПАВ образуют структуры, обладающие повышенной вязкостью и механической прочностью, разрушение которых требует определенной энергии и времени. Эти адсорбционные слои являются как бы барьером на пути сближения частиц и их агрегации (структурно-механический фактор устойчивости).
В случае ультрамикрогетерогенных систем, кроме перечисленных факторов, действует ещё и энтропийный фактор устойчивости. Сущность его определяется стремленгем дисперсной фазы к равномерному распределению по объёму системы вследствие броуновского движения. Этот фактор повышает термодинамическую устойчивость систем, снижая их общую энергию Гиббса.
Действительно, при равномерном распределении дисперсной фазы по объёму хаотичность системы выше, чем когда частицы находятся в виде агрегатов на дне сосуда..gif" border="0" align="absmiddle" alt="
такой процесс идет с уменьшением энергии Гиббса формула" src="http://hi-edu.ru/e-books/xbook707/files/f301.gif" border="0" align="absmiddle" alt="
формула" src="http://hi-edu.ru/e-books/xbook707/files/f303.gif" border="0" align="absmiddle" alt=".gif" border="0" align="absmiddle" alt=" - время половинной коагуляции; к -константа скорости коагуляции. Константа к определяется соотношением:
формула" src="http://hi-edu.ru/e-books/xbook707/files/f313.gif" border="0" align="absmiddle" alt=" (9.6)
Коагуляция лиофобных дисперсных систем может происходить в результате различных внешних воздействий: при нагревании или при охлаждении, перемешивании систем, действии ультразвука и т.д. Наиболее часто коагуляция дисперсных систем происходит при добавлении электролитов - электролитная коагуляция. Как уже описывалось выше, введете электролитов снижает высоту потенциального барьера отталкивания. Быстрая коагуляция наступает при введении определенного для данной системы количества электролита, при котором кинетическая энергия большинства частиц превышает величину указанного барьера. Это количество электролита в моль, вызывающее коагуляцию 1 литра золя называют порогом коагуляции Ск.
Коагулирующая способность электролитов зависит от заряда и радиуса ионов: порог коагуляции обратно пропорционален заряду (валентности) противоиона z в шестой степени (правило Шульца - Гарди):
Агрегативная устойчивость такого золя обеспечивается ионным фактором устойчивости. Потенциалобразующими (неиндифферентными) ионами при данном методе получения золя являются ионы формула" src="http://hi-edu.ru/e-books/xbook707/files/f238.gif" border="0" align="absmiddle" alt=" и формула мицеллы золя имеет вид:
формула" src="http://hi-edu.ru/e-books/xbook707/files/f206.gif" border="0" align="absmiddle" alt=" образуются сравнительно небольшие по размерам седиментационно - устойчивые агрегаты. Что приводит к повышению светорассеяния системы и, соответственно, - к увеличению её оптической плотности. Поэтому исследование коагуляции в данном случае удобнее всего проводить с помощью турбидиметрического метода, измеряя оптическую плотность растворов золя.