Синдром паркинсона вайта. Синдром Вольфа-Паркинсона-Уайта (ВПВ): причины, проявления, диагноз, лечение, прогноз
Сердце здорового человека работает в ритме около семидесяти ударов в минуту, это независимый процесс в отличие от движений рук и ног, поэтому человек не обращает внимания на него. Но бывает возникают нарушения, связанные с ускорением или замедлением его темпа. Впервые приступы были описаны в тридцатом году двадцатого века учеными Вольфом, Паркинсоном и Уайтом. Была выявлена причина патологии – это возникновение в сердечной мышце еще одного пути возбуждения. Она была названа – синдром Вольфа – Паркинсона – Уайта (WPW).
В нормальном состоянии проводящая система сердечной мышцы представлена таким образом, что передача электрического возбуждения происходит плавно от верхней части к нижней по заданному пути:
- Образование сердечного ритма осуществляется в клетках синоатриального узла в правом предсердии;
- После этого переходит в левое предсердие и доходит до атриовентрикулярного узла;
- Далее возбуждение через пучок Гиса по двум его ножкам распространяется по нижней части сердца;
- С помощью волокон Пуркинье возбуждением насыщаются все клетки обоих нижних камер.
- При прохождении такого пути работа сердечной мышцы синхронизируется и координируется.
При возникновении патологии электрическое возбуждение обходит атриовентрикулярный узел и попадает в желудочки правый или левый. Синдром Вольфа Паркинсона Уайта возникает при появлении еще одного пучка, который способен передавать импульсы напрямую от верхних камер сердца к нижним. По причине этого происходит нарушение в ритме. Желудочки начинают возбуждаться быстрее чем нужно, потому возникает учащенное сердцебиение.
Такое явление может возникать и у здоровых людей, при отсутствии жалоб на сердце. При профилактических осмотрах у сорока процентов людей был выявлен данный синдром и при прохождении повторных осмотров он сам собой исчезал. Это поставило ученых в замешательство. Поэтому было введено еще одно определение – феномен ВПВ.
Данный недуг мог проявляться при сильных эмоциональных и физических нагрузках, при чрезмерном употреблении алкогольных напитков. По статистике три сотых процента смертей были вызваны именно феноменом Вольфа – Паркинсона – Уайта. Точные причины синдрома WPW учеными до сих пор не установлены.
Симптомы
Как и многие заболевания синдром ВПВ имеет свои симптомы:
- Сильное сердцебиение;
- Потеря равновесия в пространстве;
- Обмороки;
- Не хватает воздуха.
У детей
Признаками синдрома ПВП у маленьких детей являются отказ от кормления, сильное потовыделение, плач, слабость, частота сокращений увеличивается до трех сот ударов в минуту.
Выделяют три пути протекания заболевания:
- Симптомы отсутствуют (примерно у сорока процентов больных);
- Самостоятельно проходящие приступы, продолжающиеся в течении двадцати минут;
- На третьей стадии учащенное сердцебиение не проходит самостоятельно. При применении специальных медикаментов приступ исчезает спустя три часа.
- На следующей стадии приступ длится больше трех часов, характерно очень сильная разрозненность в ритмах отделов сердца. Медикаменты не помогают. В таких случаях проводится оперирование.
При проведении осмотра выслушивают сердечную область и анализируют . Для более точной диагностики используют электрокардиограмму.
При исследовании синдрома Вольфа – Паркинсона – Уайта на ЭКГ у пациента выявляют следующие признаки:
- Укорочение периода перехода электрического импульса от предсердия к желудочку.
- На электрокардиограмме () специалисты отмечают — волну. Ее образование говорит о том, что существует нарушение при возбуждении желудочков. Ее величина на кардиограмме указывает на то, с какой скорость импульс проходит от верхних отделов сердца к нижним. Чем она меньше, тем правильней связь.
- Расширение желудочкового комплекса, регистрирующегося во время пульсации желудочков.
- Уменьшение периода сердечного ритма.
- Наличие отрицательного Т-зубца.
Отдельно выделяют переходящий синдром. Это говорит о том, что на приборе при нарушенной картине сердечных импульсов отмечаются и нормальные отрезки.

Опасность
Основная опасность синдрома ВПВ заключается в его внезапности. Даже когда нет особых признаков, например, при первой или второй стадии заболевания, не стоит о ней забывать. Ведь синдром WPW может о себе напомнить в самый неподходящий момент, например, при игре в футбол с друзьями во дворе.
Как говорилось выше, сильные эмоциональные и физические нагрузки могут привести к ужасным последствиям, в числе их и смерть. Поэтому, если врач обнаружил патологию не стоит игнорировать ее даже при отсутствии симптоматики.
Лечение
Синдром Вольфа – Паркинсона – Уайта существует уже довольно длительное время, поэтому люди придумали не мало способов его лечения. Это медикаментозное, хирургическое, электрофизиологические и активация блуждающего нерва.
Лечение лекарственными средствами . При синдроме Вольфа – Паркинсона – Уайта используют такие группы:
- воздействуют на рецепторы сердца, благодаря чему ритмичность замедляется. Не рекомендуются при низком давлении. Эффективен в шестидесяти процентов случаев.
- Прокаинамид применим только в поликлиниках, либо на дому врачом. Двадцать миллилитров вводится в течении десяти минут, при этом наблюдая за АД и ритмичностью. Больной должен лежать, так как препарат резко снижает давление. В восьмидесяти случаев из ста сердечный ритм восстанавливается.
- Пропафенон имеет множество противопоказаний, связанных с . При применении в девяносто процентов случаев восстанавливает сердцебиение. Кроме этого, очень удобен тем, что представлен в форме таблетки, что очень удобно.
- Строго противопоказаны такие группы медикаментов как блокаторы кальциевых каналов и аденозинтрифосфаты, так как они вызывают асинхронность деятельности мышечных волокон сердца.
Лечение с помощью операции
. Такой способ лечения синдрома Вольфа – Паркинсона – Уайта применим в крайних случаях на последней стадии. Является очень эффективным, в более чем девяносто процентов случаев пациентов больше не беспокоили проблемы с учащенным сердцебиением.
Заключается в удалении патологически образованного пучка. Таким образом, передача нервных импульсов восстанавливается.
Существуют показания для проведения оперирования:
- Если у человека приступы случаются часто;
- Приступы длятся более трех часов и не поддаются лечению препаратами;
- Синдром передался генетическим путем.
- Операцию проводят и тем людям, профессия которых заключается в спасении других людей.
Электрофизиологические методы. Электродное вмешательство проводят двумя способами:
- . Здесь вводят электрод через пищевод, так чтобы он встал наиболее близко к сердечной мышце. Через него подается небольшой разряд тока, который восстанавливает ритмичность. При успешно проведенном оперировании, эффективность метода составляет девяносто пять процентов. Но бывают случаи, когда ток приводил к беспорядочному сокращению тканей сердца, поэтому специалисты всегда перед таким вмешательством имеют при себе дефибриллятор.
- Дефибрилляция. Метод применим в тяжелых случаях, когда различное сокращение мышечных волокон сердца может привести к смерти. Подавляет любые патологические процессы, после этого нормальный ритм возвращается.
- Активирование блуждающих рефлексов. Известно, что стимулируют работу сердца импульсы, подходящие по симпатическим нервным волокнам, а затормаживающие – по парасимпатическим. Отсюда следует, что для устранения учащенного сердцебиения нужно запустить вторые.
Для этого есть две методики:
- Надавливание на глаза в течении половины минуты снижает частоту ритмов.
- Задержание дыхание и сокращение пресса активирует блуждающий нерв.
Таким образом, синдром ПВП у детей и взрослых является тяжелым заболеванием, которое никак нельзя игнорировать даже на ранних стадиях. Главной причиной ускоренной ритмичности сердечной мышцы при нем является образование дополнительного пучка, который способен передавать нервные импульсы напрямую от предсердия к желудочку.
Заболевание возникает как у мужчин (в семидесяти процентах), так и у женщин, и даже у детей. В зависимости от стадии синдрома, различается симптоматика. В начале признаки отсутствуют, и потому человек не знает, что болен.
Для того, чтобы точно определить синдром Вольфа – Паркинсона – Уайта нужно пройти обследование у кардиолога. В качестве лечения применяют лекарственные препараты, электрофизиологические методики, операции или активацию рефлексов с помощью особых упражнений.
Среди редко встречаемых нарушений проводимости сердца наиболее известен синдром Вольфа-Паркинсона-Уайта, или WPW-синдром. Чаще всего он определяется у молодых людей и подростков. Нередко диагностируется у детей первого года жизни и в таких случаях чаще всего наблюдается спонтанное выздоровление.
Синдром Вольфа-Паркинсона-Уайта (ВПУ-синдро) - врожденное состояние, связанное с аномальной проводимостью сердечной мышцы между предсердиями и желудочками, которая обеспечивает дополнительный путь для реентерабельной схемы тахикардии в сочетании с суправентрикулярной тахикардией (СВТ)
В 1930 году Вольф, Паркинсон и Уайт впервые описали молодых пациентов, которые испытывали пароксизмы тахикардии и имели характерные аномалии при электрокардиографии (ЭКГ). По именам врачей была названа болезнь, известная сегодня как синдром Вольфа-Паркинсона-Уайта.
Пациенты с синдромом WPW потенциально подвержены повышенному риску возникновения опасных желудочковых аритмий в результате проводимости по обходному пути. В результате развивается очень быстрая и хаотичная деполяризация желудочка, особенно если этому предшествует трепетание предсердий или фибрилляция предсердий.
Видео: Синдром Вольфа-Паркинсона-Уайта (WPW): причины, симптомы и патология
Описание
В 1930 году Вольф, Паркинсон и Уайт описали группу молодых пациентов, у которых были зафиксированы схожие патологические изменения на электрокардиограмме: короткий интервал PR, пароксизмы тахикардии. Сообщения о подобных случаях начали появляться в литературе в конце 1930-х и начале 1940-х годов, а термин “Вольф-Паркинсон-Уайт” (WPW) был введен в 1940 году. До этого впервые было придумано определение “pre-excitation” (“предвозбуждение”) Онеллем в знаменательной публикации в 1944 году. Дуррером и др. в 1970 году было дано лучшее описание в литературе того, что такое вспомогательный путь.
В норме импульсы проводятся от предсердий к желудочкам через атриовентрикулярный узел, расположенный в межпредсердной перегородке. При WPW-синдроме имеется дополнительное сообщение, образованное в результате аномального эмбрионального развития миокарда.
Наиболее известный дополнительный путь передачи импульсов - пучок Кента. Он может проходить как справа так и слева от АВ-узла. В результате импульсы передаются не только через АВ-узел, который несколько замедляет их скорость, но и через эти аномальные пути сообщения. На фоне этого у больного повышается риск развития тахиаритмий и связанных с ними осложнений.
Например, небольшой процент пациентов с синдромом WPW (<1%) подвергается риску внезапной сердечной смерти.
Немного статистики по ВПУ-синдрому:
- Украинские исследователи указывают на 0,2-3 % человек, больных на ВПУ-синдром, которые прошли ЭКГ-исследование.
- Распространенность преждевременного возбуждения желудочков считается равной 0,1-0,3%, или 1-3 на 1000 человек населения США.
- Российские источники указывают цифру в 0,01-0,3 %.
- Соотношение распространенности синдрома среди мужчин и женщин составляет 3:2.
- Приблизительно четыре новых диагностированных случая синдрома WPW на 100 000 населения фиксируется каждый год.
- Примерно у 80% пациентов с синдромом WPW наблюдается реципрокная тахикардия, у 15-30% развивается фибрилляция предсердий, а у 5% - трепетание предсердий.
Причины
Дополнительные пути (ДП) считаются врожденной патологией , которая связана с нарушением развития тканей в кольце АВ-узла. В редких случаях приобретенный синдром WPW имел место у пациентов, перенесших врожденную операцию на сердце, что может быть связано с нарушением функционирования эпикардиального AВ-соединения.
Семейные исследования, а также молекулярно-генетические изучения, указывают на то, что синдром WPW наряду с связанными с ним нарушениями проведения может иметь генетическую составляющую. В частности, болезнь может передаваться по наследственности с или без ассоциированных врожденных пороков сердца (ИБС); 3,4% пациентов с синдромом WPW имеют родственников с патологией ДП.
Семейная форма ВПУ обычно наследуется по аутосомно-доминантному типу. Синдром также может быть унаследован вместе с другими сердечными и некардиальными расстройствами, такими как дефекты межпредсердной перегородки, гипокалиемический периодический паралич и туберкулезный склероз. Также клиницисты давно признали ассоциацию синдрома WPW с аутосомно-доминантной семейной гипертрофической кардиомиопатией.
При наличии генных мутаций нередко развивается кардиомиопатия, характеризующаяся гипертрофией желудочков, синдромом WPW, блоком АВ-узла и прогрессирующей дегенеративной болезнью проводящей системы. Считается, что мутация приводит к нарушению фиброза АВ-кольца путем накопления гликогена в миоцитах, что вызывает предвозбуждение. Считается, что это связано с болезнью Помпе, болезнью Данона и другими заболеваниями, связанными с гликогенными расстройствами.
Мутации в ассоциированном с лизосомой мембранном белке 2 (LAMP2), которые вызывают накопление сердечного гликогена, считаются этиологией значительного числа гипертрофических кардиомиопатий у детей, особенно при скелетной миопатии, синдроме WPW или обоих заболеваниях.
Например, болезнь Данона представляет собой X-связанную лизосомальную кардиокелетную миопатию; которой мужчины чаще и сильнее страдают, чем женщины. Это вызвано мутациями в LAMP2, что способствует развитию проксимальной мышечной слабости и легкой атрофии, гипертрофии левого желудочка, синдрому WPW и умственной отсталости.
У больных с аномалией Эбштейна также могут дополнительно диагностировать синдром WPW. В таких случаях имеется несколько вспомогательных обходных путей, в основном справа, в задней части перегородки или задней стенки правого желудочка.
ВПУ-синдром может быть следствием ранее выполненного хирургического вмешательства , особенно если ткань предсердия была задета и прикреплена к миокарду желудочков.
Некоторые опухоли AВ-кольца, такие как рабдомиомы, также могут вызывать преждевременное возбуждение желудочков.
Клиника
Характерные клинические проявления синдрома WPW - эпизоды тахиаритмии ,которые могут проявиться в любое время, начиная с детского и до среднего возраста. Выраженность их может варьировать от легкого дискомфорта в грудной клетке или сердцебиения с обмороком или без него и до тяжелого сердечно-легочного нарушения и остановки сердца. Таким образом, клинику ВПУ следует рассматривать в соответствии с возрастом больного.
У младенцев могут проявляться следующие симптомы:
- Тахипноэ
- Раздражительность
- Бледность
- Непереносимость кормления
- Доказательства застойной сердечной недостаточности, если приступ не лечился в течение нескольких часов
- Ребенок не ведет себя как обычно в течение 1-2 дней
- Может присутствовать интеркуррентная лихорадка
Ребенок с синдромом WPW, который умеет разговаривать, обычно указывает на следующие симптомы:
- Боль в груди
- Сердцебиение
- Трудное дыхание
Видео: Синдром WPW РЧА сердца
Взрослые, как правило, описывают следующую клинику:
- Внезапное начало ускоренного сердцебиения
- Пульс может быть регулярным, но при этом “слишком быстрым”
- Толерантность к физической активности снижена
В 40-80% случаев симптоматика ВПУ развивается после физической или эмоциональной нагрузки, иногда после употребления алкогольных напитков.
Во время тахикардических приступов больной может иметь пониженную температуру тела, пониженное давление, нередко отмечается повышенное потоотделение.
Многие молодые люди с синдромом ВПУ могут вести привычный образ жизни с тахикардией и минимальными симптомами (например, учащенным сердцебиением, слабостью, незначительным головокружением), хотя впоследствии могут определиться чрезвычайно быстрый сердечный ритм.
В ряде случаев отмечается бессимптомное течение болезни, тогда патологию определяют, как правило, при профилактическом осмотре.
Диагностика
После физического осмотра больному назначаются обычные исследования крови, которые могут потребоваться, чтобы исключить внекардиологические заболевания, нередко вызывающие тахикардию. К ним относится:
- Общий анализ крови
- Биохимический анализ с исследованиями функции почек и количества электролитов
- Показатели функции печени
- Показатели функции щитовидной железы
- Скрининг на наркотические вещества
Диагноз синдрома WPW обычно ставится с помощью электрокардиограммы (ЭКГ), сделанной в 12 стандартных отведениях. Иногда проводятся амбулаторные исследования (например, телеметрия, холтеровский мониторинг). Болезнь лучше всего диагностируется во время тахикардии.
Признаки ЭКГ широко варьируются, но классические особенности электрокардиограммы при WPW-синдроме следующие:
- Сокращенный PR-интервал (обычно
- Слабый и медленный рост начального восхождения QRS-комплекса (дельта-волна)
- Расширенный комплекс QRS (общая продолжительность > 0,12 секунды)
- ST-сегмент-T (реполяризация) изменяется, как правило, направленный против основной дельта-волны и комплекса QRS, отражающий измененную деполяризацию

Эхокардиография необходима для следующего:
- Оценки функции левого желудочка, толщины перегородки и движения стенки
- Исключения кардиомиопатии и связанного с ней врожденного дефекта сердца (например, аномалии Эбштейна, L-транспозиции больших сосудов)
Стресс-тестирование является вспомогательным способом диагностики и может использоваться для следующего:
- Воспроизведение переходного пароксизмального приступа ВПУ, вызванного физическими упражнениями
- Чтобы зафиксировать взаимосвязь упражнений с началом тахикардии
- Чтобы оценить эффективность антиаритмической лекарственной терапии
- Чтобы определить, присутствует ли постоянное или прерывистое предвозбуждение при разных состояниях сердца
Электрофизиологические исследования (ЭФИ) могут использоваться у пациентов с синдромом WPW, чтобы определить следующее:
- Механизм клинической тахикардии
- Электрофизиологические свойства (например, проводимость, рефрактерные периоды) вспомогательного пути и нормальный атриовентрикулярный узловой и систему проводимости Пуркинье
- Количество и расположение дополнительных путей (необходимых для абляции катетера)
- Ответ на фармакологическую или абляционную терапию
Лечение
У бессимптомных пациентов антеградная проводимость через ДП может спонтанно исчезать с возрастом (одна четвертая из пациентов теряет антеградный ДП в течение 10 лет).
В других случаях лечение аритмий, связанных с WPW, включает следующее:
- Радиочастотная абляция вспомогательного пути
- Антиаритмические препараты для замедления проводимости вспомогательного пути
- AВ-узловые блокирующие препараты у взрослых пациентов, которые замедляют AВ-узловую проводимость в определенных ситуациях
Прекращение острых приступов ВПУ:
Тяжелую тахикардию устраняют путем блокирования проводимости AВ-узла следующим образом:
- Вагальными приемами (например, пробой Вальсальвы, массажем сонной артерии, обтиранием холодной или ледяной водой лица)
- Взрослым могут вводить аденозин, верапамил или дилтиазем
- Детям используют аденозин, верапамил или дилтиазем с расчетом по весу
Трепетание предсердий / фибрилляция или широкомасштабная тахикардия купируются следующим образом:
- Прокаинамид или амиодарон - при гемодинамической стабильности
- При гемодинамически нестабильной тахикардии проводят электрическую кардиоверсию, двухфазную
Радиочастотная абляция
Эта малоинвазивная процедура показана в следующих случаях:
- Пациенты с симптоматической реципрокной тахикардией (АВРТ)
- Пациенты с ДП или другими тахиаритмиями предсердий, которые имеют быстрый ответ желудочков через дополнительный путь
- Пациенты с АВРТ или ДП с быстрым ответом желудочков, обнаруженные случайно во время ЭФИ
- Бессимптомные пациенты с преддлингацией желудочков, чьи средства к существованию, профессия, страховка или психическое состояние могут зависеть от непредсказуемых тахиаритмий или у которых такие тахиаритмии могут поставить под угрозу общественную безопасность
- Пациенты с WPW и наличием внезапной сердечной смерти в семейном анамнезе
Хирургическое лечение
Радиочастотная катетерная абляция практически устраняет хирургическое вмешательство на открытом сердце у подавляющего большинства больных с WPW синдромом. Однако, за исключением показана:
- Пациентам, у которых катетерная абляция (с повторными попытками) прошла безуспешно
- Пациентам, перенесших сопутствующую сердечную хирургию
- Пациентам с другими тахикардиями с несколькими очагами, которым требуется хирургическое вмешательство (очень редко)
Долгосрочная антиаритмическая терапия
Пероральные препараты являются основой терапии у пациентов, не проходящих радиочастотную абляцию, хотя результат от долгосрочной антиаритмической терапии для профилактики дальнейших эпизодов тахикардии у пациентов с синдромом WPW остается довольно переменным и непредсказуемым. Возможные варианты:
- Препараты класса Ic (например, флекаинид, пропафенон), как правило, используются с блокирующим AВ-узел лекарством в низких дозах, чтобы избежать трепетания предсердий с проводимостью 1:1
- Препараты класса III (например, амиодарон, соталол), хотя они менее эффективны в плане изменения свойств проводимости вспомогательного пути
- Во время беременности соталол (класс B) или флекаинид (класс C)
Прогноз и осложнения
После лечения больных с синдромом WPW с помощью катетерной абляции зачастую дается благоприятный прогноз.
При бессимптомном течении с предвозбуждением на ЭКГ, как правило, заключается хороший прогноз. Во многих случаях развиваются симптоматические аритмии, которые могут быть предотвращены с помощью профилактической катетерной абляции.
Пациенты с семейной историей внезапной сердечной смерти, значительными симптомами тахиаритмии или остановкой сердца имеют неблагоприятные прогнозы. Однако, как только проводится базовая терапия, включая лечебную абляцию, прогноз заметно улучшается.
Неинвазивная стратификация риска (например, мониторинг Холтера, нагрузочный стресс-тест) может быть полезна, если внезапная и полная потеря предвозбуждения происходит на фоне упражнения или прокаинамидной инфузии. Однако это не является абсолютным предиктором отсутствия приступов аритмии.
Смертность при синдроме WPW возникает редко и часто связана с внезапной остановкой сердца. Подобное случается приблизительно 1 раз на 100 симптоматических случаев, при этом их продолжительность составляет до 15 лет.
Осложнения при ВПУ-синдроме включают следующее:
- Тахиаритмия
- Сердцебиение
- Головокружение или обморок
- Внезапная сердечная смерть
Видео: WPW (Wolff-Parkinson-White Syndrome) Animation Video
Синдром Вольфа – Паркинсона – Уайта (WPW) – предвозбуждение желудочков сердца, проходящее по дополнительному проводящему пути и обусловливающее различные нарушения сердечного ритма. В детском возрасте манифестация данной патологии встречается чаще, чем во взрослом. В большинстве случаев первое проявление синдрома WPW возникает в молодом возрасте (от 10 до 20 лет). Особенно важным является то, что вероятность развития внезапной сердечной смерти составляет от 0,15 до 0,39%, что выше общепопуляционного риска (менее 0,1%). Данное заболевание проявляется разными формами – от постоянных клинических и электрофизиологических проявлений при манифестной форме до отсутствия каких-либо субъективных и объективных симптомов при латентной форме. Дебют синдрома WPW также разный – от незначительной тахикардии до угрожающих жизни аритмий. Именно поэтому важны ранняя диагностика и наблюдение данных пациентов. На сегодняшний день ученые все больше обращают внимание на генетические аспекты различных сердечно-сосудистых заболеваний, в т. ч. синдрома WPW, что успешно используется при прогнозировании и диагностике скрытых форм заболевания. В статье представлен краткий обзор литературы по синдрому WPW: определение, классификация, «золотые стандарты» диагностики, лечения, а также генетические аспекты.
Ключевые слова:
синдром Вольфа – Паркинсона – Уайта, WPW, предвозбуждение желудочков, аритмия.
Для цитирования:
Чернова А.А., Матюшин Г.В., Никулина С.Ю., Лебедева И.И. Синдром Вольфа – Паркинсона – Уайта (литературный обзор) // РМЖ. 2017. №4. С. 269-272
Wolff-Parkinson-White syndrome (literature review)
Chernova A.A., Matyushin G.V., Nikulina S.Yu., Lebedeva I.I.
The Krasnoyarsk State Medical University named after Professor V. F. Voyno-Yasenetsky
Wolff-Parkinsov-White syndrome - pre-excitation of the ventricles of the heart, passing along an additional conducting path, causing various disturbances of the heart rhythm. The manifestation of this pathology is more common in childhood, than in the adult. In most cases, the first manifestation of WPW syndrome occurs at a young age (10 to 20 years). Especially important is that the probability of a sudden cardiac death ranges from 0.15 to 0.39%, which is above the general population risk (less than 0.1%). This disease has different forms of manifestation: from persistent clinical and electrophysiological manifestations in the overt form, to the absence of any subjective and objective symptoms in a latent form. The onset of the Wolff-Parkinson-white syndrome also varies from a mild tachycardia, to life-threatening arrhythmias. It makes important the early diagnosis and monitoring of these patients. Today scientists pay more attention to the genetic aspects of various cardiovascular diseases, including WPW syndrome, that has been used successfully in the prediction and diagnostics of latent forms of the disease. The article presents a brief review of literature on Wolff-Parkinson-White syndrome: definition, classification, "gold standards" in diagnosis, treatment, as well as genetic aspects.
Key words:
Wolff-Parkinson-White syndrome, WPW, ventricular pre-excitation, arrhythmia.
For citation:
Chernova A.A., Matyushin G.V., Nikulina S.Yu., Lebedeva I.I. Wolff-Parkinson-White syndrome (literature review) // RMJ. 2017. № 4. P. 269–272.
Обзор посвящен синдрому Вольфа – Паркинсона – Уайта
Определение синдрома Вольфа – Паркинсона – Уайта
Синдром Вольфа – Паркинсона – Уайта (ВПУ либо WPW) – сочетание электрокардиографического феномена, иллюстрирующего предвозбуждение желудочков сердца по дополнительному (аномальному) атриовентрикулярному соединению (ДАВС) и пароксизмальной атриовентрикулярной реципрокной (re-entry) тахикардии (АВРТ), возникающей в результате реализации механизма повторного входа электрического возбуждения, структурными составляющими компонентами которого являются врожденное добавочное атриовентрикулярное соединение, атриовентрикулярное соединение, миокард предсердий и миокард желудочков. Возникновение реципрокной тахикардии при синдроме WPW возможно при наличии не менее двух различных путей проведения. В структуре данной тахикардии должны присутствовать 2 компонента: предсердие (atrium) и желудочек (ventriculum), что отражается в названии – «атриовентрикулярная» тахикардия. Термин «реципрокная» является синонимом термина «re-entry». Распространение электрических импульсов может быть антероградным (от предсердий к желудочкам), ретроградным (от желудочков к предсердиям) или проводиться в обоих направлениях . Согласно рекомендациям Всемирной организации здравоохранения (ВОЗ), с 1980 г. выделяют феномен WPW и синдром WPW. О феномене WPW говорят в том случае, если у пациента на фоне синусового ритма на поверхностной электрокардиограмме (ЭКГ) имеются признаки антероградного (от предсердия к желудочкам) проведения по ДАВС (предвозбуждение желудочков), но в анамнезе нет указаний на клинические проявления АВРТ .Формы синдрома WPW
Клинически выделяются следующие формы синдрома WPW :1) манифестирующая форма – характеризуется постоянным наличием Δ-волны, имеющейся у 0,15–0,20% общей популяции, антеградным и ретроградным проведением по добавочным проводящим путям (ДПП);
2) интермиттирующая форма – выявляется в основном по клиническим данным, и ей присущи преходящие признаки предвозбуждения;
3) латентная форма – проявляется признаками предвозбуждения только при стимуляции предсердий (чаще всего левого) через коронарный синус при инвазивном электрофизиологическом исследовании (ЭФИ) или замедлении проведения по атриовентрикулярному узлу (АВУ) в результате массажа каротидного синуса, введения верапамила или пропранолола;
4) скрытая форма – характеризуется только ретроградным предвозбуждением предсердий. Поэтому пароксизмов антидромной тахикардии или мерцания предсердий с проведением через ДПП не развивается. При синусовом ритме признаков синдрома WPW на электрокардиограмме не выявляется.
Значительно реже – лишь у 5–10% пациентов с синдромом WPW наблюдается вариант антидромной re-entry тахикардии. При обнаружении двух и более ДАВС, которые участвуют в re-entry при АВРТ, говорят о множественном синдроме WPW . Обычное течение синдрома WPW делится на 3 стадии :
– 1-я стадия – кратковременные (менее 30 мин) приступы ортодромной тахикардии, купирующиеся рефлекторно;
– 2-я стадия – повышение частоты и длительности (от 30 мин до 3 ч) приступов, купирующихся одним антиаритмическим препаратом, иногда в сочетании с вагусными пробами. Для профилактики тахикардии применяют медикаментозное лечение;
– 3-я стадия – частые и длительные (более 3 ч) приступы ортодромной тахикардии, появление приступов желудочковой тахикардии, фибрилляции предсердий или желудочков, нарушения проводящей системы (синдром слабости синусового узла, блокада ножек пучка Гиса, атриовентрикулярные блокады), толерантности к антиаритмическим препаратам.
Дополнительные проводящие пути
M.S. Arruda et al. (1998), модифицировав более раннюю классификацию, предложили подразделять ДПП по их локализации в 3-х главных областях на септальные, правой свободной стенки и левой свободной стенки . Септальные ДПП: переднесептальные, передние парасептальные, средне-септальные – вдоль кольца трикуспидального клапана (ТК), заднесептальные – вдоль кольца ТК и кольца митрального клапана (МК). ДПП правой свободной стенки: правый передний, правый переднебоковой, правый боковой, правый заднебоковой, правый задний. ДПП левой свободной стенки: левый переднебоковой, левый боковой, левый заднебоковой, левый задний.Синдром WPW в популяции
Синдром WPW встречается в 0,1–3,1% из 1000 ЭКГ, а у больных с врожденными пороками сердца – в 0,5%; во всех возрастных группах и выявляется у 1–30 на 10 тыс. человек. Соотношение между мужчинами и женщинами составляет 3:2 . В детском возрасте синдром WPW встречается чаще (7–10%), чем во взрослом (3–6%) . В большинстве случаев клиническая манифестация синдрома WPW возникает в молодом возрасте (от 10 до 20 лет). Вероятность развития внезапной смерти (ВСС) в течение 10 лет составляет от 0,15 до 0,39%, что выше общепопуляционного риска ВСС (менее 0,1%) .При исследовании пациентов с синдромом WPW, перенесших остановку сердца, ретроспективно определили ряд критериев, с помощью которых можно выявить больных с повышенным риском ВСС. К ним относятся: укороченный интервал R–R (менее 250 мс) при предвозбуждении желудочков во время спонтанной или индуцированной ФП, анамнез симптомной тахикардии, множественные дополнительные пути проведения, аномалия Эбштейна.
В Тайваньском национальном университетском госпитале были проведены обширные исследования. Отобраны случаи синдрома WPW у людей моложе 50 лет с 2000 по 2010 гг. Выявлено 6086 пациентов (61% – мужчины, 39% – женщины). По полученным данным, распространенность составила 0,36 на 1000 и 0,61 на 1000 в группе людей от 20–24 лет. Риск ВСС составил 0,071% в общей группе и 0,02% в группе лиц 20–24 лет. За исследуемый период времени случилось 42 ВСС у пациентов в среднем в возрасте 29 лет. Сопутствующие ССЗ были отмечены у 158 пациентов (2,6%), включая 42 пациентов с аномалией Эбштейна, которая повышает риск ВСС. Радиочастотная аблация (РЧА) проведена у 2527 пациентов в среднем возрасте 25,7 года, у 11 пациентов в возрасте 5 лет и у 2231 человека в возрасте после 15 лет; из общего числа – 6% повторных РЧА .
В литературе встречаются описания семейных вариантов синдрома WPW . Эти формы редки, но именно при семейном синдроме WPW говорят о более высокой частоте ВСС . У пациентов с семейной формой синдрома WPW фибрилляция предсердий (ФП) наблюдалась в 38–44% случаев, в отличие от 15–20% при спорадических формах заболевания .
В работах по изучению синдрома преждевременного возбуждения желудочков (ПВЖ) авторами проведены медико-генетическое консультирование и проспективное наблюдение 36 пациентов с синдромом WPW и 222 их кровных родственников, а также 40 пациентов с синдромом Клерка – Леви – Критеско (КЛК) и 227 их родственников. Синдром или феномен ПВЖ, т. е. наличие ДПП, впервые были диагностированы у 32% (n=72 из 222) обследованных родственников I–IV степеней родства: среди них синдром WPW отмечался у 4 (1,8%), синдром КЛК – у 12 (5,4%), феномен КЛК – у 56 (25%) родственников. В семьях больных с синдромом КЛК синдром и феномен ПВЖ были выявлены впервые у 36% (n=82 из 227) обследованных родственников I–IV степеней родства; у 17 (7%) обнаружен синдром КЛК, у 60 (26%) – феномен КЛК, а у 5 (2%) – феномен WPW .
Структура аритмий
В структуре всех наджелудочковых тахикардий (НЖТ), исключая ФП, удельный вес аритмий достигает 54–75%. Из них АВРТ при манифестирующем синдроме WPW составляют 39,4%, АВРТ со скрытыми ретроградными ДАВС - 24,1% . Атриовентрикулярная re-entry тахикардия – наиболее распространенная тахикардия (70%) среди аритмий с узким QRS у детей и вторая по распространенности у взрослых . Замечено, что у молодых пациентов течение тахиаритмий при синдроме WPW более агрессивное, чем у пожилых . В контексте синдрома WPW ФП имеет иное значение. Наличие ФП у пациента с синдромом WPW способно гораздо быстрее привести к желудочковой аритмии вследствие наличия ДПП. У пациентов с синдромом WPW существуют 2 механизма возникновения ФП: связанный с ДПП или не связанный с ДПП . В ряде случаев при возникновении трепетания предсердий (ТП) или ФП у больных с синдромом WPW появляется возможность развития желудочковой тахикардии и фибрилляции желудочков (ФЖ). При этом ФЖ может стать первым проявлением болезни. В одном из зарубежных исследований ФЖ стала первым проявлением у 8 из 15 пациентов (53%) . Летальность от аритмии при синдроме WPW составляет 1,5% . Стоит упомянуть о медикаментозно индуцированном трепетании предсердий (или 1С-индуцированном) у пациентов со «злокачественным» пучком Кента. Это редкая форма прогностически неблагоприятного проаритмогенного действия антиаритмических препаратов. В зависимости от возможности записи ЭКГ частота встречаемости 1С-индуцированного пароксизма мерцательной аритмии колеблется от 3,5% до 20% . Р.Р. Маматказина и соавт. в своей статье описывают такой редкий случай .Диагностика
По стандартной ЭКГ возможно определение локализации ДПП.Тип А характеризуется положительной D-волной в отведениях V1–V2. ДПП между предсердием и желудочком располагается с левой стороны перегородки, раньше возбуждается ЛЖ.
Тип В проявляется отрицательной D-волной в отведениях V1–V2, но положительной – в отведениях V4–V6. ДПП располагается справа, и, соответственно, раньше возбуждается правый желудочек.
Тип С имеет положительную D-волну в отведениях V1–V4 и отрицательную в V5–V6, ДПП располагается в латеральной стенке ЛЖ и соединяет субэпикардиальный участок левого предсердия с боковой стенкой ЛЖ .
Интересный подход для повышения точности диагностики локализации ДПП по ЭКГ был предложен Л.А. Бокерией и соавт. . С помощью регрессионного анализа была выявлена зависимость расположения ДПП от амплитуды D-волны в 12 отведениях ЭКГ. Точность локализации ДПП по 11 сегментам АВ-борозды составила 100% при ретроспективном и 88% при проспективном анализе, что значительно выше, чем при помощи других алгоритмов. Но на сегодняшний день внутрисердечное электрофизиологическое исследование (ЭФИ) остается «золотым стандартом» и, по мнению большинства авторов, обязательным этапом предоперационной топической диагностики ДПП. Разработаны рекомендации Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции (ВНОА) по проведению ЭФИ у пациентов с аритмиями сердца (2005 г.) .
Стоит отметить также, что описаны случаи, когда диагноз «синдром WPW» ставят интраоперационно, при выполнении операций по причине другой, не связанной с сердцем патологии. Зарубежными авторами описан случай, когда у мужчины 32 лет, готовившегося к урологической операции, был выявлен интермиттирующий синдром WPW. После премедикации и проведения спинальной анестезии, на мониторе во время операции и в раннем послеоперационном периоде постоянно фиксировался синдром WPW. Авторы пишут о необходимости проведения ЭФИ перед операциями и в случае установления синдрома WPW, по возможности, выполнения РЧА до плановой операции. В литературе описаны случаи, когда синдром WPW находили уже в процессе операции при спинальной анестезии .
Радиочастотная аблация в лечении синдрома WPW
Катетерная аблация постоянным током и радиочастотная энергия сравнительно недавно были применены для лечения пациентов с хроническими АВ-тахикардиями, идиопатическими желудочковыми тахикардиями и различными видами предсердных тахикардий с многообещающими результатами .Эффективность процедуры РЧА в лечении атриовентрикулярных re-entry и атриовентрикулярных узловых re-entry тахикардий составляет более 95%. С другой стороны, исследователи отмечают, что риск рецидивирования ФП после катетерной абляции положительно коррелирует с возрастом пациента и повышается при других структурных заболеваниях сердца или дилатации левого предсердия . У пациентов в возрасте до 50 лет это происходит в 10–12% случаев, старше 50 лет – у 35–40%, старше 60 лет – более чем у 55% . В таких случаях РЧА ДПП проводят повторно. Даже после проведения эффективной радиочастотной абляции ДПП у 25% пациентов продолжает рецидивировать ФП, и специалисты предполагают, что ФП может возникать в результате сопутствующих электрофизиологических изменений в предсердиях, не связанных с наличием добавочного пути.
Предрасположенность к развитию ФП при синдроме WPW может объясняться уменьшением продолжительности рефрактерного периода клеток миокарда предсердий и нарушением внутри- и межпредсердной проводимости . Также есть предположения , что возникновение ФП после РЧА связано и с гемодинамическими нарушениями, развивающимися во время тахикардии и приводящими к повышению тонуса симпатической нервной системы, гипоксемии миокарда предсердий.
В 6–10% случаев РЧА сопровождается развитием осложнений: повреждением сердца (тампонада) и сосудов (гематомы), развитием тромбоэмболий , экссудативного перикардита . Поэтому некоторые специалисты предпочитают использовать метод открытой электродеструкции ДПП.
В настоящее время осложнения при проведении эндокардиального ЭФИ и РЧА ДПП можно разделить на 4 группы: обусловленные лучевой нагрузкой; связанные с пункцией и катетеризацией сосудов (гематома, тромбоз глубоких вен, перфорация артерий, артериовенозная фистула, пневмоторакс); осложнения при катетерных манипуляциях (повреждение клапанов сердца, микроэмболия, перфорация коронарного синуса или стенки миокарда, диссекция коронарных артерий, тромбоз); обусловленные РЧ-воздействием (АВ-блокада, перфорация миокарда, спазм или окклюзия коронарных артерий, транзиторное нарушение мозгового кровообращения, цереброваскулярные осложнения).
Наиболее частыми серьезными осложнениями являются полная АВ-блокада и тампонада сердца. Частота возникновения необратимой полной АВ-блокады колеблется от 0,17 до 1%. Чаще всего данное осложнение возникает в ходе РЧА септальных ДПП, расположенных рядом с АВ-узлом и пучком Гиса. Частота тампонады сердца варьирует от 0,13 до 1,1%. Летальность, связанная с процедурой аблации ДПП, не превышает 0,2% .
В 2005 г. разработаны рекомендации ВНОА по лечению ФП и синдрома предвозбуждения желудочков . У детей РЧА не является методом выбора, поскольку имеет очень высокий риск осложнений. По мнению G. Vignati et al. , РЧА следует проводить детям не младше 12 лет, т. к. с увеличением возраста пациента существует вероятность развития фиброза в зоне присоединения ДПП и утраты им проводящей способности.
Генетика
Семейная форма синдрома WPW наследуется по аутосомно-доминантному типу и обусловлена мутацией в гене PRAKG2 (7q3) . PRKAG2 – важнейший фермент, влияющий на выработку внутриклеточной энергии и мутации в гене, кодирующем этот фермент, может вызывать гипертрофическую кардиомиопатию (ГКМП), синдром WPW, нарушения проводимости, мышечную дистрофию и болезни накопления гликогена.Стоит отметить, что у пациентов с ГКМП также обнаруживается мутация гена LAMP2 . LAMP-2 – X-сцепленный ген, который кодирует белки, регулирующие интеграцию и функционирование лизосом. Мутация этого гена приводит к болезни Данона, которая включает в себя такие проявления, как синдром WPW, гипертрофическая кардиомиопатия, мышечная дистрофия, умственная отсталость .
Возвращаясь к уже известному гену PRKAG – предиктору синдрома WPW, следует отметить, что его секвенирование у пациентов с WPW выявляет миссенс-мутации в 6 позициях. Зарубежные исследования показали, что мутация гена PRKAG2 характерна не только при синдроме WPW, но и при синусовой брадикардии, блокаде правой ножки пучка Гиса и коротком интервале PQ . В литературе описаны случаи изолированного семейного синдрома WPW (синдром WPW, ассоциированный с гипертрофией сердца и/или с поражением АВУ) с отсутствием мутации в гене PRKAG2 у всех членов семьи. Мутация гена PRKAG2 также не обнаружена у пациентов с несемейной формой синдрома WPW . В одной из статей зарубежных авторов описан случай синдрома WPW у 3-х родных сестер . Более того, у всех девушек найден леволатеральный ДПП. Родители девушек и другие ближайшие родственники оказались здоровы. Что примечательно, несмотря на одинаковое расположение ДПП, лишь у одной из сестер имелось антеградное проведение, и болезнь манифестировала со стойкой тахикардии, другие же отмечали лишь редкие сердцебиения в подростковом возрасте, которые их не беспокоили. Тем не менее авторы отмечают, что, возможно, со временем и у других двух сестер болезнь могла проявиться .
Другие зарубежные исследователи наблюдали 2 семьи (всего 70 человек): 57 и 13 человек. Всем пациентам были выполнены ЭКГ с 12 отведениями и эхокардиография. Был секвенирован ген – предиктор синдрома WPW (PRKAG2) у здоровых и больных членов обеих семей. По результатам исследования было выявлено в первой семье 23 человека с синдромом WPW, а во второй – 8. У пациентов были обнаружены преждевременное возбуждение желудочков и гипертрофия сердца .
Заключение
Учитывая мировой опыт наблюдения пациентов с синдромом WPW, можно заключить, что на сегодняшний день стандартное обследование должно включать 12-канальную ЭКГ, ЭхоКГ, холтеровское мониторирование и обязательно генетический тест .При подозрении на скрытую или латентную форму, не проявившуюся на одномоментном и суточном ЭКГ, и при положительном генетическом тесте проводится ЭФИ.
ЭхоКГ на первом этапе также позволяет заподозрить скрытые формы синдрома WPW по наличию таких патологий, как пролапс МК и дополнительные хорды, которые часто сопутствуют синдрому WPW.
Что касается лечения синдрома WPW, то на сегодняшний день все большую распространенность получает РЧА. Хотя стоит отметить, что данная методика не имеет 100% эффективности и абсолютных показаний. При выборе данного метода лечения необходимо учитывать множество факторов: показания и противопоказания по рекомендации ВНОК.
Литература
1. Ардашев В.Н., Ардашев А.В., Стеклов В.И. Лечение нарушений сердечного ритма. М.: Медпрактика-М, 2005. 240 с. .
2. Кушаковский М.С. Аритмии сердца. СПб.: Фолиант, 1998. 640 с. .
3. Abott J., Eldar M., Seger J. et al. Combined Mahaim and Kent pathways // Circulation. 1985. Vol. 72. P. 269–275.
4. Ward D., Benett О., Camn J. et al. Mechanism of junctional tachycardia showing ventricular preexcitation // Br Heart J. 1984. Vol. 52. P. 369–375.
5. Klein G.J., Gulamhusein S.S. Intermittent preexcitation in the Wolff-Рarkinson-White syndrome // Am J. Cardiol. 1983. Vol. 52. P. 292–296.
6. MсClelland J.H., Wang X., Beckman K.J et al. Radiofrequency catheter ablation of right atriofascicular (Mahaim) accessory pathways guided by accessory pathway activation potentials // Circulation. 1994. Vol. 89. P. 2655–2666.
7. Ардашев А.В., Рыбаченко М.С., Желяков Е.Г., Шаваров А.А., Волошко С.В. Синдром Вольфа – Паркинсона – Уайта: классификация, клинические проявления, диагностика и лечение // Кардиология. 2009. № 10. C. 84–94 .
8. Бокерия Л.А. Тахиаритмии. Л.: Медицина, 1989. 296 с. .
9. Munger T.M., Packer D.L., Hammill S.C. et al. A population study of the natural history of Wolff-Parkinson-White syndrome in Olmsted County, Minnesota, 1953–1989 // Circulation. 1993. Vol. 87. P. 866–873.
10. Arruda M. S., McClelland J. H., Wang X. et al. Development and validation of an ECG algorithm for identifying accessory pathway ablation site in Wolf-Parkinson-White syndrome // J. Cardiovasc. Electroph. 1998. Vol. 9. P. 212.
11. Timmermans C., Smeets J.L., Rodriguez L.M. et al. Aborted sudden death in the Wolff–Parkinson–White syndrome // Am J Cardiol. 1995. Vol.76. P. 492–494.
12. Миклашевич И.М., Школьникова М.А., Сыркин А.Л. и др. Естественное течение суправентрикулярных тахикардий, манифестировавших в детском возрасте // Вестник аритмологии. 2002. № 29. С. 60–65 .
13. Huttin O., Brembilla-Perrot B. Relationships between age and accessory pathway location in Wolff-Parkinson-White syndrome // Ann. Cardiol. Angeiol. (Paris). 2008. Vol. 57. Р. 225–230.
14. Голицын С.П., Малахов В.И., Бокалов С.А. и др. Диагностика и возможности противоаритмического лечения злокачественных желудочковых нарушений ритма сердца // Тер. Арх. 1991. № 9. C. 38–44 .
15. Ардашев А.В., Ардашев В.Н., Желяков Е.Г. и др. Показатели внутрисердечной гемодинамики у больных с синдромом WPW до и после операции РЧА // Анналы аритмологии. 2007. № 3. С. 37 .
16. Lu C.-W., Wua M.-H., Chen H.-C. et al. Epidemiological profile of Wolff–Parkinson–White syndrome in a general population younger than 50 years of age in an era of radiofrequency catheter ablation // International Journal of Cardiology. 2014. Vol. P. 530–534.
17. Wathen M., Natale A., Wolfe K. et al. Initiation of atrial fibrillation in the Wolff-Parkinson-White syndrome: the importance of the accessory pathway // Am Heart J. 1993. Vol. 125. P. 753–759.
18. Бокерия Л. А., Меликулов А. Х. Синдром Вольфа – Паркинсона – Уайта // Анналы аритмологии. 2008. № 2. С. 5–19 .
19. Zhang L.P., Hui B., Gao B.R. High risk of sudden death associated with a PRKAG2-related familial Wolff-Parkinson-White syndrome // Journal of Electrocardiology. 2011. Vol. 44. P. 483–486.
20. Фомина И.Г., Кулешов Н.П., Логунова Л.В., Моргунов Н.Б., Тарзиманова А.И. Роль медико-генетического консультирования в первичной профилактике аритмий // Кардиоваскулярная терапия и профилактика. 2007. № 7(7). С. 74–77 .
21. Kugler J.D., Danford D.A., Deal B.J. et al. Radiofrequency catheter ablation for tachyarrhythmias in children and adolescents. The Pediatric Electrophysiology Society // N Engl J Med. 1994. Vol. 330. P. 1481–1487.
22. Calkins H., Sousa J., el-Atassi R. et al. Diagnosis and cure of the Wolff–Parkinson–White syndrome or paroxysmal supraventricular tachycardias during a single electrophysiologic test // N Engl J Med. 1991. Vol. 324. P. 1612–1618.
23. Фролов А.И., Зотов С.Ю., Зинченко Ю.В. Возрастные отличия электрофизиологических параметров у пациентов с синдромом Вольфа – Паркинсона – Уайта // Укр. мед. журн. 2001. № 2. C. 9–15 .
24. Centurion O.A. Atrial Fibrillation in the Wolff-Parkinson-White syndrome // Journal of Atrial Fibrillation. 2011. Vol. 2(5). P. 899–915.
25. Brembilla-Perrot B., Tatar C., C. Suty-Selton. Risk factors of adverse presentation as the first arrhythmia in Wolff-Parkinson-White syndrome // PACE. Wiley Periodicals, Inc. September 2010. Vol. 33. P. 1074–1081.
26. Falk R.H. Proarrhythmic responses to atrial antiarrhythmic therapy. In: Falk RH, Podrid PJ, eds. Atrial fibrillation: mechanisms and management // NY: Raven Press. 1992. P. 283–305.
27. Маматказина Р.Р., Колос И.П., Сердюк С.Е., Мазыгула Е.П., Свешников А.В. 1С-индуцированное трепетание предсердий у пациента с синдромом WPW: клинический случай и обзор литературы // Рациональная фармакотерапия в кардиологии. 2012. № 8(2). С. 196–200 .
28. Сумароков А.В., Моисеев В.С. Клиническая кардиология: Руководство для врачей. М.: Универсум паблишинг, 1995. С. 213–214 .
29. Бокерия Л.А., Ревишвили А.Ш., Полякова И., Кулакова Г.В. Новый метод топической диагностики дополнительных путей проведения у больных с синдромом Вольфа – Паркинсона – Уайта // Кардиология. 1989. Т. 29. № 7. С. 49–53 .
30. Бокерия Л.А. Рекомендации Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции по проведению клинических исследований, катетерной аблации и имплантации антиаритмических устройств. М.: Золотой Абрикос, 2005. 238 с. .
31. Nishikawa K., Mizoguchi M., Yukika H. et al. Concealed Wolff-Parkinson white syndrome detected during spinal anaesthesia // Anaesthesia. 2007. Vol. 48. P. 1061.
32. Jackman W.M., Wang X., Friday K.J. et al. Catheter ablation of accessory atrioventricular pathways (Wolff – Parcinson – White syndrome) by radiofrequency current // N. Engl. J. Med. 1991. Vol. 324. P. 1605–1611.
33. Mujovic N., Grujic M., Mrdja S. et al. Recurrence of atrial fibrillation after successful radiofrequency catheter ablation of accessory pathway in patients with Wolff–Parkinson–White syndrome // Srp. Arh. Celok. Lek. 2010. Vol. 138. P. 170–176.
34. Локшин С.Л., Правосудович С.А., Дзяк В.Г. О возможности устранения мерцательной аритмии у пациентов с синдромом WPW // Вестник аритмологии. 1998. № 7. С. 36–41.
35. Shafquat A., Imdad A., Khalid S. et al. Cardiac electrophysiology studies and ablations for treatment of supraventricular arrhythmias-an initial experience from Karachi // J. Pak. Med. Assoc. 2011. Vol. 61. P. 173–175.
36. Cagli K.E., Topaloglu S., Aras D. et al. Evaluation of atrial vulnerability immediately after radiofrequency catheter ablation of accessory pathway in patients with Wolff– Parkinson–White syndrome // J. Interv. Card. Electrophysiol. 2009. Vol. 26. Р. 217–224.
37. Emkanjoo Z., Ebadi K., Sharifi M. et al. Electrophysiological characteristics of orthodromic reentrant tachycardia in patients with Wolf – Parkinson – White syndrome and atrial fibrillation // Int. J. Cardiol. 2010. Vol. 12. P. 196–198.
38. Zhang Y., Wang L. Atrial vulnerability is a major mechanism of paroxysmal atrial fibrillation in patients with Wolff – Parkinson – White syndrome // Med. Hypotheses. 2006. Vol. 7. Р. 1345–1347.
39. Кушаковский М.С. Аритмии сердца. СПб.: Гиппократ, 1998. 544 с. .
40. Brembilla-Perrot B., Chometon F., Groben L. et al. Are the results of electrophysiological study different in patients with a pre-excitation syndrome, with and without syncope? // Europace. 2008. Vol. 10. Р. 175–180.
41. Sethi K.K., Dhall A., Chadha D.S. et al. WPW and preexcitation syndromes // J. Assoc. Physicians India. 2007. Vol. 15. P. 10–15.
42. Shapira A.R. Catheter ablation of supraventricular arrhythmias and atrial fibrillation // Am Fam Physician. 2009. Vol. 80. Р. 1089–1094.
43. Schaer B.A., Maurer A., Sticherling C. et al. Routine echocardiography after radiofrequency ablation: to flog a dead horse? // Europace. 2009. Vol. 11. Р. 155–157.
44. Гусак В.К., Кузнецов А.С., Комиссаров С.И. и др. Хирургическое лечение больных с WPW-синдромом в сочетании с фибрилляцией предсердий // Укр. мед. часопис. 2001. № 5(25). С. 135–138 .
45. Guidelines for the management of atrial fibrillation. The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology // Eur. Heart J. 2010. Vol. 31. P. 2369–2429.
46. Melina G., Codecasa R., Capecchi I. et al. Successful aortic valve repair for severe aortic insufficiency caused by radiofrequency ablation // J. Thorac. Cardiovasc. Surg. 2005. Vol. 130. P. 564–565.
47. Milewicz D.M., Seidman C.E. Genetics of Cardiovascular Disease // Circulation. American Heart Association. November 2000. Vol. 14. P. 102–111.
48. Murphy R.T., Mogensen J., McGarry K. et al. Adenosine monophosphate-activated protein kinase dis-ease mimicks hypertrophic cardiomyopathy and Wolff- Parkinson-White syndrome. Natural history // Journal of the American College of Cardiology. 2005. Vol. 45. Vol. 922–930.
49. Yang Z., McMahon C.J., Smith L.R. Danon disease as an underrecognized cause of hypertrophic car-diomyopathy in children // Circulation. 2005. Vol. 112. P. 1612–1617.
50. Gollob M.H., Seger J.J., Gollob T. et al. Novel PRKAG2 mutation responsible for the genetic syndrome of ventricular preexcitation and conduction system disease with childhood onset and absence of cardiac hypertrophy // Circulation. 2001. Vol. 104. P. 3030–3033.
51. Vaughan C.J., Hom Y., Okin D.A. et al. Molecular genetic analysis of PRKAG2 in sporadic Wolff- Parkinson-White syndrome // J Cardiovasc Electrophysiol. 2003. Vol. 14. P. 263–268.
52. Ehtisham J., Watkins H. Is Wolff-Parkinson-White syndrome a genetic disease? // J. Cardiovasc Electrophysiol. 2005. Vol. 16. P. 1258–1262.
53. Bittinger L.D., Tang A.S., Leather R.A. Three Sisters, One Pathway // Canadian Journal of Cardiology. 2011. Vol. 27. P. 870.
54. Gollob M.H., Green M. S., Tang A.S-L. et al. Identification of a gene responsible for familial Wolff–Parkinson–White syndrome // The New England Journal of Medicine. 2001. Vol. 344(24). P. 1823–1831.
55. Vohra J., Skinner J., Semsarian C. Cardiac genetic investigation of young sudden unexplained death and resuscitated out of hospital cardiac arrest // Heart, Lung and Circulation. 2011. Vol. 20. P. 746–750.
Синдром Вольфа-Паркинсона-Уайта (синдром WPW) — электрокардиографический синдром, который связан с предвозбуждением желудочков сердца, возникающим в результате наличия дополнительного (аномального) предсердно-желудочкового соединения (ДПЖС). Предвозбуждение желудочков провоцирует развитие различных аритмий, поэтому у больного может наблюдаться наджелудочковая тахикардия, фибрилляция или трепетание предсердий, предсердная и желудочковая экстрасистолия и соответствующая субъективная симптоматика — ощущение сердцебиения, одышка, гипотензия, головокружение, обмороки, боли в грудной клетке.
| МКБ-10 | I45.6 |
|---|---|
| МКБ-9 | 426.7 |
| DiseasesDB | 14186 |
| MedlinePlus | 000151 |
| eMedicine | emerg/644 med/2417 |
| MeSH | C14.280.067.780.977 |
| OMIM | 194200 |
Общие сведения
Первое известное описание аномального атриовентрикулярного (проводящего) пути принадлежит Giovanni Paladino, который в 1876 г. описал расположенные на поверхности предсердно-желудочковых клапанов мышечные волокна. Giovanni Paladino не связывал выявленные структуры с проводимостью сердца, а предполагал, что они способствуют сокращению клапанов.
Первую ЭКГ, отражающую предвозбуждение желудочков, в 1913 г. представили A.E. Coch и F.R. Fraser, однако они не выявили причинно-следственные связи между выявленным предвозбуждением и тахикардией.
Похожие электрокардиографические особенности у больных, страдающих пароксизмальной тахикардией, в 1915 г. зафиксировал F.N. Wilson, а в 1921 г. — A.M. Wedd.
G.R. Mines в 1914 г. выдвинул предположение, согласно которому добавочный путь может являться частью цепи re-entry (повторный вход волны возбуждения).
2 апреля 1928 года к Paul White обратился 35-летний преподаватель, страдающий от приступов учащенного сердцебиения. В ходе обследования Louis Wolff (ассистент Paul White) провел электрокардиографическое исследование, выявившее изменение комплекса QRS и укорочение интервала P-Q.
Аномальная деполяризация желудочков, провоцирующая изменения начальной части комплекса QRS, долгое время была предметом дискуссий, поскольку детальный механизм развития тахикардии до появления методики внутрисердечной регистрации сигналов оставался невыясненным.
К 1930 г. L. Wolff, P. White и англичанин John Parkinson обобщили 11 похожих случаев, определив комбинацию укорочения интервала P-Q, атипичной блокады ножки и пароксизмов тахикардии, а также фибрилляции и трепетания предсердий, как клинико-электрокардиографический синдром.
- Scherf и М. Holzman в 1932 году предположили, что изменения ЭКГ провоцируются аномальным атриовентрикулярным соединением. К тем же выводам независимо от данных исследователей пришли в 1933 г. F.С. Wood и С.С. Wolferth. Предпосылкой к данным выводам послужило открытие в 1893 г Kent дополнительного атриовентрикулярного мышечного пучка у животных («пучок Кента).
В 1941 году S.A. Levin и R.B. Beenson для обозначения данного синдрома предложили использовать термин «синдром Wolff — Parkinson – White», который используется до настоящего времени.
В конце 60-х годов ХХ века при проведении операции на открытом сердце благодаря методике эпикардиального картирования D. Durrer и J.R. Ross зарегистрировали предвозбуждение желудочков. Воспользовавшись программируемой стимуляцией, D. Durrer с соавторами доказали, что в результате преждевременного предсердного и желудочкового сокращения у больных с синдромом WPW может возникать и прекращаться тахикардия.
В 1958 году R.C. Truex с соавторами при исследовании сердец зародышей, новорожденных и младенцев первых 6 месяцев жизни выявили в отверстиях и щелях фиброзного кольца многочисленные дополнительные связи. Эти данные в 2008 году подтвердили исследования N.D. Hahurij и соавторов, которые обнаружили у всех обследованных эмбрионов и плодов на ранних стадиях развития наличие дополнительных мышечных путей.
В 1967 году F.R. Cobb с коллегами продемонстрировали возможность лечения синдрома WPW, устранив аномальное проведение в процессе операции на открытом сердце.
Внедрение методики высокочастотной деструкции позволило М. Borggrefe в 1987 году устранить правостороннее добавочное АВС, а в 1989 году К.Н. Kuck выполнил успешную деструкцию левостороннего аномального соединения.
Синдром Вольфа-Паркинсона-Уайта выявляется у 0,15 — 0,25 % человек от числа общей популяции. Ежегодный прирост составляет 4 новых случая в год на 100 000 населения.
Частота распространения синдрома возрастает до 0,55 % у лиц, состоящих в близких родственных отношениях с пациентами с синдромом WPW. При «семейном» характере заболевания вероятность наличия множественных добавочных АВС увеличивается.
Аритмии, связанные с дополнительным АВС, составляют 54–75 % от всех наджелудочковых тахикардий. При манифестирующем синдроме WPW на долю пароксизмальной атриовентрикулярной реципрокной тахикардии (ПАВРТ) приходится 39,4 %, а на долю скрытых ретроградных ДАВС — 21,4%.
Около 80% больных с синдромом WPW – это больные с реципрокными (круговыми) тахикардиями, у 15-30% выявляется фибрилляция предсердий, а у 5% – трепетание предсердий. Желудочковую тахикардию выявляют в редких случаях.
Хотя дополнительные АВ-соединения (ДАВС) — врожденная аномалия, синдром WPW может проявить себя впервые в любом возрасте. В большинстве случаев клиническую манифестацию синдрома отмечают у пациентов в возрасте от 10 до 20 лет.
Данный синдром у детей выявляется в 23% случаев, причем по данным некоторых авторов чаще всего он проявляется на первом году жизни (среди мальчиков регистрируется 20 случаев на 100 000, а среди девочек — 6 на 100 000 человек), а по другим данным большая часть случаев регистрируется в возрасте 15-16 лет.
Второй пик манифестации синдрома приходится на 3-е десятилетие у мужчин и на 4-е – у женщин (соотношение мужчин и женщин составляет 3:2).
Смертность при синдроме WPW (внезапная коронарная смерть) связана с перерождением фибрилляции предсердий в фибрилляцию желудочков и частым желудочковым ответом по одному или более дополнительным путям проведения с коротким антероградным рефрактерным периодом. Как первое проявление синдрома наблюдается у небольшого числа пациентов. В целом риск внезапной коронарной смерти составляет 1 на 1000.
Формы
Поскольку аномальные пути проведения обозначают по месту начала и области вхождения, в 1999 г. F.G. Cosio предложил анатомо-физиологическую классификацию локализации ДПЖС (дополнительных предсердно-желудочковых соединений), согласно которой все ДАВС разделяются на:
- правосторонние;
- левосторонние (наблюдаются чаще всего);
- парасептальные.

В 1979 г. W.Sealy и соавторы предложили анатомо-хирургическую классификацию, согласно которой ДПЖС подразделяется на левосторонние, правосторонние, париетальные, а также разделяемые прилегающей к фиброзному кольцу областью мембранозной перегородки переднесептальные и заднесептальные.
Существует также классификация M. E. Josephson и соавторов, предлагающая разделять ДПЖС на:
- ДПЖС правой свободной стенки;
- ДПЖС левой свободной стенки;
- ДПЖС свободной задней левой стенки;
- переднеперегородочные;
- заднеперегородочные.
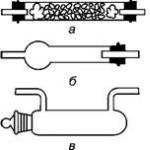
В зависимости от морфологического субстрата синдрома выделяются его анатомические варианты с добавочными мышечными АВ-волокнами и добавочными «пучками Кента» (специализированными мышечными АВ-волокнами).
Добавочные мышечные АВ-волокна могут:
- проходить через добавочное левое или правое париетальное АВ-соединение;
- проходить через фиброзное аортально-митральное соединение;
- идти от ушка левого или правого предсердия;
- быть связаны с аневризмой средней вены сердца или синуса Вальсальвы;
- быть септальными, верхними или нижними парасептальными.
Специализированные мышечные АВ-волокна могут:
- происходить из подобной по структуре атриовентрикулярному узлу рудиментарной ткани;
- входить в правую ножку пучка Гиса (быть атриофасцикулярными);
- входить в миокард правого желудочка.
- феномен WPW, для которого характерны электрокардиографические признаки предвозбуждения желудочков в результате проведения импульса по дополнительным соединениям, но клинические проявления АВ реципрокной тахикардии (re-entry) не наблюдаются;
- синдром WPW, при котором предвозбуждение желудочков сочетается с симптоматической тахикардией.
В зависимости от путей распространения выделяют:
- манифестирующий синдром WPW, при котором фронт деполяризации распространяется по ДАВС в антероградном направлении на фоне синусового ритма;
- скрытую форму синдрома, при которой на фоне синусового ритма признаки предвозбуждения желудочков отсутствуют, проведение по ДАВС ретроградное, а по нормальному АВ-соединению – антероградное;
- латентную форму синдрома, при которой признаки перевозбуждения желудочков наблюдаются только при программированной или учащающейся стимуляции, отсутствующей в обычном состоянии;
- Интермиттирующий синдром WPW, при котором проявляющееся непостоянно перевозбуждение желудочков чередуется с нормальным АВ-проведением;
- множественную форму синдрома WPW, при которой выявляется не одно дополнительное предсердно-желудочковое соединение.
Причины развития
Синдром Вольфа-Паркинсона-Уайта развивается в результате сохранения добавочных АВ-соединений вследствие незавершенного кардиогенеза. Согласно проведенным исследованиям, на ранних стадиях развития плода дополнительные мышечные пути являются нормой. На этапе формирования трикуспидального и митрального клапанов и фиброзных колец происходит постепенная регрессия дополнительных мышечных связей. Добавочные АВ-соединения в норме истончаются, их количество уменьшается, и уже на 21-й неделе гестации они не выявляются.
При нарушениях формирования фиброзных АВ-колец некоторые из дополнительных мышечных волокон сохраняются и становятся анатомической основой ДАВС. В большинстве случаев гистологически идентифицированные дополнительные пути являются «тонкими нитями», которые в обход структур нормальной проводящей системы сердца соединяют желудочки и миокард предсердий через атриовентрикулярную борозду. Дополнительные пути внедряются в ткань предсердий и базальную часть миокарда желудочков на разной глубине (локализация может быть как субэпикардиальной, так и субэндокардиальной).
При наличии синдрома WPW могут выявляться сопутствующие врожденные патологии сердца, хотя структурно синдром с ними не связан. Такими аномалиями могут быть синдром Эларса-Данло, синдром Марфана и . В редких случаях наблюдаются также врожденные пороки (аномалия Эбштейна, дефект межжелудочной и межпредсердной перегородки).
Наличие дополнительных путей проведения может носить семейный характер (обычно это множественная форма).
Патогенез
Синдром Вольфа-Паркинсона-Уайта развивается на основе предвозбуждения с участием дополнительных проводящих структур, способных на антеградное, ретроградное проведение или их сочетание.
В норме проведение с предсердий на желудочки происходит при помощи АВ узла и системы Гиса–Пуркинье. Наличие дополнительных путей шунтирует нормальный путь проведения, поэтому возбуждение части миокарда желудочков возникает раньше, чем при нормальном проведении импульса.
В зависимости от размера активированной через аномальное соединение части миокарда увеличивается степень предвозбуждения. Степень предвозбуждения также увеличивается при увеличении частоты стимуляции, введении аденозина, кальциевых и бета – блокаторов, предсердной экстрасистолии в связи с удлинением времени проведения в АВС. Минимальным предвозбуждением отличается синдром, при котором выявляются левосторонние латеральные ДАВС, особенно в сочетании с ускоренным проведением в АВ узле.
Дополнительные пути с исключительно антероградной проводимостью выявляются редко, а только с ретроградной (латентная форма) — часто. «Манифестирующие» ДПЖС обычно проводят импульсы как в антероградном, так и в ретроградном направлении.

Пароксизмы суправентрикулярной тахикардии, мерцание и трепетание предсердий вызвано формированием круговой волны возбуждения (re-entry).
Индукция reentry-тахикардии возникает при условии наличия:
- двух каналов проведения;
- по одному из каналов однонаправленного блока проведения;
- возможности антероградного проведения в обход блока, по другому каналу;
- возможности ретроградного проведения по одному из имеющихся каналов.
Связанную с механизмом re-entry атриовентрикулярную тахикардию при синдроме WPW подразделяют на:
- Ортодромную, при которой по атриовентрикулярному (АВ) узлу импульсы антероградно проводятся в желудочки из предсердия при помощи специализированной проводящей системы, а из желудочков на предсердия импульс передается ретроградно по ДПЖС. Деполяризация миокарда желудочков осуществляется по нормальной системе Гиса – Пуркинье. ЭКГ при этом фиксирует тахикардию с «узкими» комплексами QRS.
- Антидромную, при которой импульсы из предсердий в желудочки передаются при помощи антероградного проведения по ДПЖС, а ретроградное проведение осуществляется через второй ДПЖС (при множественной форме) или АВ узел. Возбуждение миокарда желудочков наблюдается в области вхождения в желудочек ДАВС (обычно париетально, у стенки желудочка). ЭКГ регистрирует тахикардию с широкими комплексами QRS. Данный тип тахикардии выявляется у 5-10% пациентов.
Местом расположения ДАВС могут быть любые участки вдоль атриовентикулярной борозды, кроме области между митральным и аортальным клапанами.
В большинстве случаев левосторонние аномальные соединения находятся под эпикардом, а фиброзное кольцо развито нормально. Правосторонние аномальные соединения локализуются как эндокардиально, так и эпикардиально с одинаковой частотой, и в большинстве случаев сопровождаются дефектами строения фиброзного кольца.
Часто выявляется пересечение добавочными АВС предсердно-желудочковой борозды по диагонали, вследствие чего желудочковая и предсердная части не соответствуют друг другу. Направленность аномальных соединений отличается «центробежным» характером.
Симптомы
До клинической манифестации синдрома WPW, которая возможна в любом возрасте, течение заболевания может быть асимптомным.
Синдром Вольфа-Паркинсона-Уайта проявляется такими нарушениями сердечного ритма, как:
- реципрокная наджелудочковая тахикардия, которая выявляется у 80% больных;
- фибрилляция предсердий (у 15-30%);
- трепетание предсердий у 5% больных (частота составляет 280-320 уд. в мин.).
В отдельных случаях синдром WPW сопровождается предсердной и желудочковой экстрасистолией или желудочковой тахикардией.
Аритмия возникает при физическом напряжении, под влиянием эмоциональных факторов или без видимых причин. Приступ сопровождается:
- ощущением сердцебиения и замирания сердца;
- кардиалгией (болью в области сердца);
- чувством нехватки воздуха.
При мерцании и трепетании предсердий возникают головокружения, обмороки, артериальная гипотензия, одышка.
Пароксизмы аритмии начинаются внезапно, длятся от нескольких секунд до нескольких часов и могут купироваться самостоятельно. Приступы могут быть как ежедневными, так и наблюдаться 1-2 раз в год.
Структурные патологии сердца в большинстве случаев отсутствуют.
Диагностика
Для диагностики синдрома WPW проводят комплексную клинико-иснтрументальную диагностику:
- ЭКГ в 12 отведениях, позволяющую выявить укороченный PQ-интервал (менее 0,12 с), наличие дельта-волны, вызванной «сливным» сокращением желудочков, и расширение комплекса QRS более 0,1 с. Быстрое проведение через AB-соединение дельта-волны вызывает ее расширение.
- Трансторакальную эхокардиографию, позволяющую визуализировать кардиоваскулярные анатомические структуры, оценить функциональное состояние миокарда и т.д.
- Мониторирование ЭКГ по Холтеру, помогающее обнаружить преходящие нарушения ритма.
- Чреспищеводную электрокардиостимуляцию, помогающую обнаружить дополнительные пути проведения и спровоцировать пароксизмы аритмии, позволяющие определить форму заболевания. Манифестирующий синдром сопровождается признаками предвозбуждения на исходной электрокардиограмме, которые усиливаются при стимуляции. При ортодомной реципрокной тахикардии признаки предвозбуждения при стимуляции внезапно исчезают, а интервал St2-R2 увеличивается.
- Электрофизиологическое исследование сердца, позволяющее точно выяснить расположение дополнительных путей и их количество, а также определить клиническую форму синдрома.
Синдром WPW на ЭКГ при скрытой форме отражается отсутствием признаков преждевременного возбуждения желудочков во время синусового ритма. Выявить синдром помогает электростимуляция желудочков, вызывающая у больного тахикардию.
Дифференциальная диагностика синдрома WPW проводится при помощи блокады ножек пучка Гиса, которая сопровождается уменьшением частоты тахикардии на стороне расположения дополнительных путей.
Лечение
Синдром Вольфа-Паркинсона-Уайта лечится медикаментозными или хирургическими методами (выбор метода зависит от состояния пациента).
Медикаментозная терапия включает постоянный прием антиаритмических препаратов. При ортодромной тахикардии используются препараты, воздействующие:
- на АВ узел и на ДАВС одновременно (флекаинид, пропафенон, соталол);
- на АВ узел (дигоксин), но только при случаях ретроградно-функционирующих ДАВС;
- на ДАВС (дизопирамид, амиодарон, хинидин).
Поскольку препараты наперстянки, верапамил, дилтиазем, аденозин (кальциевые блокаторы) при фибрилляции предсердий способны усиливать частоту желудочкового ответа и таким образом провоцировать развитие фибрилляции желудочков, эти препараты не назначают.
Хирургические операции на «открытом сердце» ввиду возможных осложнений и эффективности более простых методов проводят исключительно в случаях наличия сочетанной патологии или невозможности катетерных операций. Устранение аномального проведения выполняется при помощи эндокардиального или эпикардиального хирургического доступа.
Антитахикардитические устройства в настоящее время при синдроме WPW не используются из-за риска развития фибрилляции предсердий.
Наиболее эффективным методом лечения (успешным для 95 % больных) является катетерная радиочастотная деструкция (абляция) ДАВС, которая основана на разрушении патологических проводящих путей. Данный метод предполагает трансаортальный (ретроградный) или транссептальный доступ.
Нашли ошибку? Выделите ее и нажмите Ctrl + EnterВерсия для печати
Загрузка формы..." data-toggle="modal" data-form-id="42" data-slogan-idbgd="7313" data-slogan-id-popup="10619" data-slogan-on-click="Получить цены в клинике AB_Slogan2 ID_GDB_7313 http://prntscr.com/nvtslo" class="center-block btn btn-lg btn-primary gf-button-form" id="gf_button_get_form_0">Получить цены в клинике
Симптомы и протекание заболевания
Синдром Вольфа-Паркинсона-Уайта может протекать бессимптомно, если частота сердечных сокращений не превышает 200 ударов в минуту и выявляться только при кардиографическом исследовании. Если же тахикардия превышает 200 сердечных сокращений, возникают клинические проявления в виде ощущения «выскакивания» сердца, головокружения, нередко возникает потеря сознания.
Согласно статистике у 70% пациентов синдром ВПУ протекает в легкой форме, не вызывая нарушений кровообращения и потери трудоспособности за счет приспособительных механизмов.
Основные проявления синдрома WPW:
- Внезапно возникающий приступ сердцебиения.
- Перебои в работе сердца.
- Пульсация в голове или горле.
- Общая слабость, головокружение, снижение толерантности к физической нагрузке, повышенная утомляемость на фоне приступа.
- Возможна потеря сознания.
- Одышка.
- На фоне приступа возможно развитие головокружения или потери сознания.
- Снижение артериального давления (артериальная гипотензия или нестабильное АД).
Синдром Вольфа-Паркинсона-Уайта может сопровождаться внезапными эпизодами очень быстрых сердечных сокращений и ощущением сердцебиения.
Уже у детей первого года жизни при затяжном приступе может развиваться сердечная недостаточность. Иногда кажется, что ребенок задыхается; порой он все время спит, перестает хорошо есть; появляются быстрые видимые пульсации грудной стенки.
Первые эпизоды обычно возникают в подростковом возрасте или около 20 лет. Типичные приступы начинаются внезапно, часто во время физической нагрузки. Они длятся от нескольких секунд до нескольких часов, но редко дольше 12 часов. У молодого и в остальном физически здорового человека приступы тахикардии обычно вызывают немного симптомов, но очень быстрые сердечные сокращения неприятны и беспокоят человека. Иногда они могут вести к обмороку или сердечной недостаточности.
Типичная для синдрома Вольфа-Паркинсона-Уайта тахикардия иногда переходит в фибрилляцию предсердий. Последняя особенно опасна приблизительно для 1% пациентов с синдромом Вольфа-Паркинсона-Уайта, потому что у них дополнительный путь проведения может очень быстро проводить к желудочкам намного больше импульсов, чем нормальный путь. Результат - чрезвычайно быстрый желудочковый ритм, являющийся потенциальной угрозой для жизни. Сердце не только очень неэффективно работает, когда желудочки сокращаются в таком темпе, - подобный ритм может переходить в опасную для жизни фибрилляцию желудочков.
Лучшие государственные клиники Израиля
Лучшие частные клиники Израиля
Лечение заболевания
Существует два метода лечения синдрома WPW: консервативный и хирургический.
- Консервативный метод. Предупреждение приступов тахикардии (учащенное сердцебиение). Для этого используются профилактические антиаритмические препараты (препараты, предупреждающие развитие нарушения ритма (любой ритм, отличный от нормального, - ритма здорового человека). Некоторые антиаритмические препараты противопоказаны при синдроме WPW, так как могут ухудшить его течение. Это: блокаторы медленных кальциевых каналов (препараты, воздействующие на клетки сердца и сосудов, вызывая снижение частоты сердечных сокращений, уменьшая тонус сосудов); β-адреноблокаторы (препараты, препятствующие стимуляции рецепторов к адреналину и норадреналину (гормоны стресса)); сердечные гликозиды (препараты, увеличивающие силу сердечных сокращений). Прекращение приступа тахикардии. Для этого используется внутривенное введение антиаритмических препаратов.
- Хирургический метод. Показаниями к хирургическому лечению являются:
- частые приступы фибрилляции предсердий (более 1 раза в неделю);
- приступы тахикардии с нарушением общего кровообращения (потеря сознания, слабость, снижение давления);
- сохранение приступов тахикардии при приеме антиаритмических препаратов;
- ситуации, когда длительная лекарственная терапия нежелательна (молодой возраст).
При неэффективности консервативного лечения, а также при тахикардии более 200 ударов в минуту применяют хирургическое лечение - вживляется искусственный водитель ритма в сердце или деструкция дополнительного нервного пучка Кента.
Популярным методом лечения данного заболевания является радиочастотная абляции пучка Кента. Метод имеет значительные преимущества по сравнению с имплантацией кардиостимулятора, так как не требует вскрытия грудной клетки, вживления аппаратуры и ухода за ней, постоянного контроля врача и приема антикоагулянтов. Суть процедуры состоит в том, что к сердцу через бедренные сосуды подводят проводник (тонкая трубка). По проводнику подается импульс, разрушающий (прижигающий) пучок. После манипуляции проводится тестирование - контроль на ее эффективность. При необходимости сразу же выполняется повторная аблация до достижения полного эффекта.
Диагностика заболевания
Любая диагностика начинается с визуального осмотра у специалиста, который при прослушивании работы миокарда наблюдает патогенные шумы. К тому же аномальная частота сердечного ритма также вызывает определенную тревогу, заставляя пройти полное клиническое обследование.
Диагностика синдрома Вольфа-Паркинсона Уайта не ограничивается лишь обычным электрокардиографическим исследованием. Применяются современные методы:
- суточное (холтеровское) и фрагментарное ЭКГ-мониторинг;
- электрофизиологическое исследование сердца (ЭФИ);
- эндокардиальное картирование;
- компьютерная томография сердца;
- ультразвуковое сканирование;
- эхокардиография;
- магнитно-резонансная томография;
- пищеводная кардиография, которая по сравнению с обычной ЭКГ дает более точные результаты;
- холтеровская кардиография, позволяющая в течение суток постоянно регистрировать ритм сердца больного в обычном для него режиме жизни, как во время бодрствования, так и во время сна, с помощью специального портативного электронного датчика.
Обычно на полный комплекс диагностических мероприятий уходит не более двух суток.
Загрузка формы..." data-toggle="modal" data-form-id="42" data-slogan-idbgd="7310" data-slogan-id-popup="10616" data-slogan-on-click="Запрос цены AB_Slogan2 ID_GDB_7310 http://prntscr.com/mergwb" class="center-block btn btn-lg btn-primary gf-button-form" id="gf_button_get_form_951500">Запрос цены
Цены
Так как патологии очень различны, методы их лечения также существенно отличаются друг от друга. Сосудистая хирургия в Израиле проводит разнообразные операции по типу, уровню сложности и т.п. которые эффективно помогают устранить проблему и спасти жизнь человеку.